
23)Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на: • одноатомные • двухатомные(гликоли) • трехатомные.
По характеру углеводородного радикала выделяют следующие спирты: • предельные, содержащие в молекуле лишь предельные углеводородные радикалы • непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода • ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода.
![]()
Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже. Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует
заметить, что спирты, содержащие две
гидроксильные группы при одном атоме
углерода, неустойчивы и самопроизвольно
разлагаются (подвергаются перегруппировке
атомов) с образованием альдегидов и
кетонов:

Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: • первичные, в молекулах которых гидроксильная группа связана с первичным атомомуглерода • вторичные, в молекулах которых гидроксильная группа связана с вторичным атомом углерода • третичные, в молекулах которых гидроксильная группа связана с третичным атомом углерода, например:
Химические свойства спиртов.
Замещение водорода ОН группы под действием оснований (кислотные свойства).
Взаимодействие с электрофильными реагентами по атому кислорода с неподеленной парой электронов (основные и нуклеофильные свойства).
Взаимодействие с нуклеофильными реагентами по -углеродному атому, несущему частичный положительный заряд (реакции нуклеофильного замещения ОН группы).
Дегидратация (участвуют связь С-Н в -положении и связь С-О).
Окисление (участвуют связь С-Н в -положении и связь О-Н).
Замещение ОН группы действием PCl5, основано на предварительном превращении спирта в эфиры кислот фосфора и серы, которые затем атакуются галогенид-анионом.
ROH + PCl5 RCl + POCl3 + HCl
Реакции с РСl5 изопропиловый спирт.
CH3-CH(CH3)-OH + PCl5 = CH3-CH(CH3)-Cl + POCl3 + HCl
Дегидратация спиртов
При нагревании в присутствии кислотных катализаторов спирты отщепляют воду с образованием алкенов. Реакции дегидратации (элиминирования) протекают параллельно с образованием простых эфиров (замещением). Дегидратации способствует высокая температура. Например: Склонность спиртов к дегидратации возрастает в ряду: первичный < вторичный < третичный
При дегидратации спиртов соблюдается правило Зайцева. (при дегидрадации и дегидрогалогенировании водород отщепляется от соседнего менее гидрированного атома углерода)
24) Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на: • одноатомные • двухатомные(гликоли) • трехатомные.
По характеру углеводородного радикала выделяют следующие спирты: • предельные, содержащие в молекуле лишь предельные углеводородные радикалы • непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода • ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода.
![]()
Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже. Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует
заметить, что спирты, содержащие две
гидроксильные группы при одном атоме
углерода, неустойчивы и самопроизвольно
разлагаются (подвергаются перегруппировке
атомов) с образованием альдегидов и
кетонов:
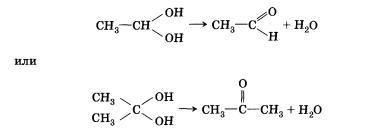
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: • первичные, в молекулах которых гидроксильная группа связана с первичным атомомуглерода • вторичные, в молекулах которых гидроксильная группа связана с вторичным атомом углерода • третичные, в молекулах которых гидроксильная группа связана с третичным атомом углерода, например:
Кислотные свойства (спиртов )
Спирты взаимодействуют с активными металлами (Na, K, Mg, Al и др.) с образованием алкоголятов:
C2H5OH + Na С2H5O-Na+ + 0,5 H2 (атилат натрия)
3(СH3)2CHOH + Al ((CH3)2CHO)3Al + 1,5 H2
изопропилат алюминия
Алкоголяты
образуются также при действии на спирты
сильных оснований:
![]() При
взаимодействии спиртов со щелочами
равновесие сдвинуто в сторону гидролиза
алкоголятов, так как спирты являются
более слабыми кислотами, чем
вода:
При
взаимодействии спиртов со щелочами
равновесие сдвинуто в сторону гидролиза
алкоголятов, так как спирты являются
более слабыми кислотами, чем
вода:
![]() Кислотные
свойства( фенолов)Фенолы
являются более сильными кислотами, чем
спирты, что обусловлено стабилизацией
фенолят аниона за счет делокализации
отрицательного заряда по ароматическому
кольцу (см. лек. №4). Для сравнения приведем
величины рКа в
воде при 25оС
для фенола (10,00), для циклогексанола
(18,00).
Фенолы являются более сильными
кислотами, чем вода, поэтому феноляты,
в отличие от алкоголятов, могут быть
получены из фенолов действием водных
растворов щелочей.
Карбоновые
кислоты и большинство неорганических
кислот, например, угольная, превосходят
по кислотности фенол, что используется
для выделения фенола из щелочных
растворов.
C6H5O- Na+ +
CO2 +
H2O C6H5OH
+ NaHCO3
Электроноакцепторные
заместители в ароматическом кольце
увеличивают, а электронодонорные –
уменьшают кислотность фенолов. Так,
2,4,6-тринитрофенол (пикриновая кислота)
по кислотности (рКа=
0,4) сравним с карбоновыми кислотами.
Кислотные
свойства( фенолов)Фенолы
являются более сильными кислотами, чем
спирты, что обусловлено стабилизацией
фенолят аниона за счет делокализации
отрицательного заряда по ароматическому
кольцу (см. лек. №4). Для сравнения приведем
величины рКа в
воде при 25оС
для фенола (10,00), для циклогексанола
(18,00).
Фенолы являются более сильными
кислотами, чем вода, поэтому феноляты,
в отличие от алкоголятов, могут быть
получены из фенолов действием водных
растворов щелочей.
Карбоновые
кислоты и большинство неорганических
кислот, например, угольная, превосходят
по кислотности фенол, что используется
для выделения фенола из щелочных
растворов.
C6H5O- Na+ +
CO2 +
H2O C6H5OH
+ NaHCO3
Электроноакцепторные
заместители в ароматическом кольце
увеличивают, а электронодонорные –
уменьшают кислотность фенолов. Так,
2,4,6-тринитрофенол (пикриновая кислота)
по кислотности (рКа=
0,4) сравним с карбоновыми кислотами.
Замещение ОН группы на галоген
Спирты взаимодействуют с галогеноводородами и галогенидами фосфора и серы с образованием галогенпроизводных.
1. Действие галогеноводородов.
R-OH + HHal R-Hal + H2O
Реакция
протекает через стадию протонирования
ОН группы с последующим нуклеофильным
замещением по механизму SN1
или SN2.
![]() Первичные
спирты реагируют по механизму SN2.
Реакция идет медленно, так как в протонных
растворителях (вода, спирты) галогенид-ионы
– слабые нуклеофилы. Вторичные и
третичные спирты реагируют по механизму
SN1.
Таким образом, реакционная способность
спиртов возрастает в ряду:
Первичные
спирты реагируют по механизму SN2.
Реакция идет медленно, так как в протонных
растворителях (вода, спирты) галогенид-ионы
– слабые нуклеофилы. Вторичные и
третичные спирты реагируют по механизму
SN1.
Таким образом, реакционная способность
спиртов возрастает в ряду:
первичный < вторичный < третичный
Реакционная способность галогеноводородов увеличивается в ряду:
HCl < HBr < HI
параллельно с возрастанием силы кислот и нуклеофильности галогенид-анионов. Однако HI не может быть использована, так как легко восстанавливает спирты до углеводородов. HBr реагирует с первичными, вторичными и третичными спиртами. HCl действует только на третичные спирты.

Для
вторичных и первичных спиртов требуется
присутствие катализатора – кислоты
Льюиса.
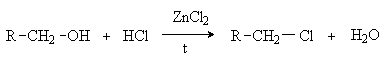
Алкоголяты и феноляты, солеобразные соединения, продукты замещения водорода гидроксильной группы спиртов(алкоголяты) и фенолов (феноляты). Алкоголяты получают растворением щелочных, щёлочноземельных металлов иалюминия в безводных спиртах, например
2C2H5OH + 2Na2C2H3ONa + H2
Феноляты образуются при взаимодействии фенолов с водными растворами щелочей. Алкоголяты легко гидролизуются.
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с p-электронной системой бензольного кольца полярность связи О–Н увеличивается. Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты:
C6H5OH + NaOH ® C6H5ONa + H2O
Образование фенолята железа под действием раствора хлорида железа (III) является качественной реакцией на фенолы (раствор приобретает коричнево-фиолетовую окраску).

Алкоголяты)
Алкоголяты (алкоксиды) — соединения общей формулы R-OM, где R — алкил (или замещенный алкил), а M — катион металла либо другой катион, формально — продукты замещения атома протона гидроксильной группы спиртов другим катионом[1].
Получают взаимодействием спиртов с металлами. (R — радикал, Me — металл)
2ROH + 2Me → 2ROMe + H2↑
Фенолят натрия (или феноксид) образуется при взаимодействии щелочей с фенолами. Кислотные свойства фенолов относительно мало выражены. Эти вещества не окрашивают лакмусовую бумажку. Фенолят натрия в отличие от алкоголятов может существовать в водных растворах щелочей, при этом он не разлагается. Феноляты легко разлагаются при взаимодействии с кислотами (даже самыми слабыми, например, угольной). Все же кислотные свойства фенолов выражены сильнее, чем в алифатических спиртах.
Алкоголяты.
Спирты-в-ва нейтральные но в незначительной степени они проявляют амфотерные свойства. При взаимодействии спиртов со щелочными металлами водород гидроксила замещается металлом с обр.алкоголятов:2С 2H 5ONa+2Na2C 2H5 ONa+H2
алкоголят(этилат натрия)
алкоголяты легко разл.водой. C 2H5 ONa+НОНC2Н5ОН+NaОНтак спирты более слабые кислоты.чем вода .кислотные свойства спиртов убывают в след.порядке.перв> вторич >третичные
Алкилирование —введение алкильного заместителя в молекулу органического соединения. Типичными алкилирующими агентами являются алкилгалогениды,алкены, эпоксисоединения, спирты, реже альдегиды, кетоны, эфиры, сульфиды, диазоалканы. Катализаторами алкилирования являются минеральные кислоты,кислоты Льюиса а также цеолиты.
Алкилирование широко применяется в химической и нефтехимической промышленности.
Алкилирование производят алкилгалогенидами (например, C2H5CI), эфирами неорганических кислот [например, диметилсульфатом (CH3O)2S02],олефинами, например этиленом, и др. Так, бензол с этиленом в присутствии AlCl3 образует этилбензол: C6H6 + CH2= СН2®С6Н5СН2СНз. Алкилирование применяют в технике для получения высокооктанового топлива (изооктана и др.), гомологов бензола (кумола, этил-бензола и т. д.) и многих других соединений. Ацилирование — введение ацильного остатка RCO- (ацила) в состав органического соединения, как правило, путём замещения атома водорода, введение остатка уксусной кислоты CH3CO- называют ацетилированием, бензойной C6H5CO- — бензоилированием, муравьиной HCO- — формилированием. В зависимости от атома, к которому присоединяется ацильный остаток, выделяют C-ацилирование, N-ацилирование, O-ацилирование.
В качестве ацилирующих агентов используют галогенангидриды и ангидриды кислот.
При C-ацилировании по Фриделю-Крафтсу катализатором обычно служит хлорид алюминия:

25)
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на: • одноатомные • двухатомные(гликоли) • трехатомные.
По характеру углеводородного радикала выделяют следующие спирты: • предельные, содержащие в молекуле лишь предельные углеводородные радикалы • непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода • ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода.
![]()
Органические вещества, содержащие в молекуле гидрок-сильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например, гидроксибензол фенол. Подробнее со строением, свойствами и применением фенолов мы познакомимся позже. Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует
заметить, что спирты, содержащие две
гидроксильные группы при одном атоме
углерода, неустойчивы и самопроизвольно
разлагаются (подвергаются перегруппировке
атомов) с образованием альдегидов и
кетонов:
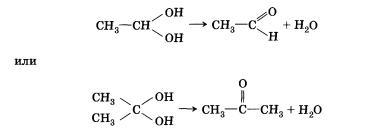
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид. По характеру атома углерода, с которым связана гидроксильная группа, спирты делятся на: • первичные, в молекулах которых гидроксильная группа связана с первичным атомомуглерода • вторичные, в молекулах которых гидроксильная группа связана с вторичным атомом углерода • третичные, в молекулах которых гидроксильная группа связана с третичным атомом углерода, например
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода,
то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к
другой), разрыв связи О–Н происходит легче, чем в одноатомных спиртах. Поэтому они
проявляют более ярко выраженные кислотные свойства, чем одноатомные спирты.
Многоатомные спирты с «несоседними» ОН-группами подобны по свойствам
одноатомным спиртам, т.к. взаимное влияние ОН-групп не проявляется.
Взаимодействие с активными металлами:
Взаимодействие с гидроксидами щелочных металлов:
HO – CH2 − CH2 – OH + 2NaOH NaO – CH2CH2 – ONa + 2H2O
Качественные реакции на карбоновые кислоты. На карбоновые кислоты обычно подчеркивают образование цветных осадков с тяжелыми металлами. Но наиболее осуществимая качественная реакция на метановую кислоту HCOOH. При добавлении концентрированной серной кислоты H2SO4 к раствору муравьиной кислоты образуется угарный газ и вода: HCOOH —H2SO4—> CO↑ + H2O Угарный газ можно поджечь. Горит синем пламенем: 2CO + O2 —t—> 2CO2
Из многоосновных кислот рассмотрим качественную реакцию на щавелевую H2C2O4(HOOC-COOH). При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II): Cu2+ + C2O42- ——> CuC2O4↓
Щавелевая кислота также, как и муравьиная, разлагается концентрированной серной кислотой: H2C2O4 —-H2SO4—> CO↑ + CO2↑ + H2O
Серная кислота с этиловым спиртом образует в начале этилсульфат: C2H5OH + H2SO4 → C2H5O-SO2-OH + H2O Далее молекула этилсерной кислоты C2H5O-SO2-OH может реагировать со второй молекулой спирта с образование диэтилсульфата: C2H5O-SO2-OH + C2H5OH → C2H5O-SO2-OC2H5 Эти реакции происходят при прибавлении 96%-ного спирта к концентрированной серной кислоте при комнатной температуре.
Спирты и фенолы
Спиртами называют алифатические соединения, содержащие гидроксильную группу (алканолы, алкенолы, алкинолы); гидроксиарены или ароматические гидроксипроизводные называются фенолами . Название спирта образуется прибавлением суффикса -ол к названию соответствующего углеводорода или на основе углеводородного радикала
Фенолы характеризуются более сильными кислотными свойствами, чем спирты, последние в водных растворах не образуют карбониевые ионы AIk – O –, что связано с меньшим поляризующим действием (электроакцепторными свойствами акильных радикалов по сравнению с ароматическими).
Спирты и фенолы тем не менее легко образуют водородные связи, поэтому все спирты и фенолы имеют более высокие температуры кипения, чем соответствующие углеводороды.
Если углеводородный радикал не обладает ярко выраженными гидрофобными свойствами, то эти спирты хорошо растворяются в воде. Водородная связь обусловливает способность спиртов переходить при отвердении в стеклообразное, а не кристаллическое состояние.
