- •Лекция 10 спирты и фенолы
- •1. Одноатомные спирты
- •1.1. Классификация, номенклатура, изомерия.
- •1.2. Способы получения
- •1.2.1. Из алкенов
- •1.2.2. Из галогенопроизводных.
- •1.2.3. Синтез спиртов с использованием реактива Гриньяра.
- •1.2.4. Восстановление карбонильных соединений.
- •1.3. Физические свойства
- •1.4. Химические свойства
- •1.4.1. Реакции с разрывом связи о-н Кислотно-основные свойства
- •1.4.1.1. Этерификация кислотами
- •1.4.2.1.Реакции с галогеноводородами
- •1.4.2.2. Реакции с галогенидами фосфора и серы
- •1.4.3. Окисление
- •1.4.4. Восстановление
- •2. Многоатомные спитры
- •2.1. Классификация, номенклатура, изомерия.
- •2.2. Способы получения.
- •2.3. Физические и химические свойства
- •2.3.1. Образование солей с металлами
- •2.3.2. Образование сложных эфиров
- •2.3.3. Дегидратация
- •3.2. Физические свойства
- •3.3. Химические свойства
3.3. Химические свойства
1. Кислотные свойства.
Фенолы являются кислотами более сильными, чем спирты и вода, но слабее угольной кислоты. Поэтому фенолы легко реагируют с раствором едкого натра с образованием фенолята:
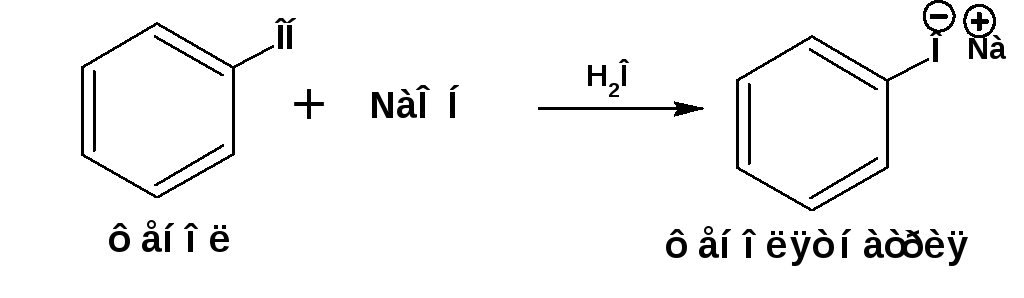
Электронодонорные заместители в пара- орто-положениях понижают кислотные свойства. Электроноакцепторные заместители в пара- и орто-положениях повышают кислотные свойства. Так 2,4,6-тринитрофенол обладает выраженными кислотными свойствами. Поэтому называется пикриновой кислотой. Способен вытеснять угольную кислоту из ее солей, т.е. способен образовывать фенолят в растворе соды.
Связь между углеродом бензольного кольца и атомом кислорода гидроксильной группы обладает повышенной прочностью за счет частичной двоесвязанности. Поэтому реакции с разрывом связи С-О для фенола не характерны.
Восстановление
К числу реакций, протекающих с разрывом связи С-О, относится восстановление фенола цинковой пылью при перегонке. В ходе реакции гидроксильная группа замещается водородом:

Другим примером разрыва связи С-О является нуклеофильное замещение гидроксильной группы в активированных фенолах. Например, замещение гидроксильной группы в 2,4,6-тринитрофеноле на галоид по механизму «присоединение-отщепление»:

В основном химические свойства фенола формируют реакции, протекающие с разрывом связи С-Н, а также реакции замещения ароматическое кольцо.
О-алкилирование
Сам фенол является слабым основанием, поэтому в реакции алкилирования с галоидными алкилами обычно используют фенолят натрия:

О-ацилирование
Кислотные свойства фенола играют позитивную роль в реакциях фенола с хлорангидридами и ангидридами карбоновых кислот:

В форме фенолята фенол не ацилируется хлорангидридом бензойной кислоты, поскольку у хлорангидрида бензойной кислоты связь хлора и углерода более прочная, чем такая связь в хлорангидридах алифатических кислот:

С хлорангидридами минеральных кислот также образуются эфиры. Причем с пятихлористым фосфором образуются эфиры, хлорированные в ароматическое кольцо.
Реакции замещения
Галогены реагируют с фенолом без катализатора. Фенол взаимодействует с бромом в водном растворе. Причем реакция не останавливается на стадии монобромирования. В начале образуется 2,4,6-трибромфенол, а затем тетрабромпроизводное:

Аналогично под действием концентрированной азотной кислоты в присутствии серной кислоты фенол превращается в тринитрофенол (пикриновую кислоту):

Мононитрофенолы образуются при нитровании фенола разбавленной азотной кислотой в среде уксусной кислоты при комнатной температуре:

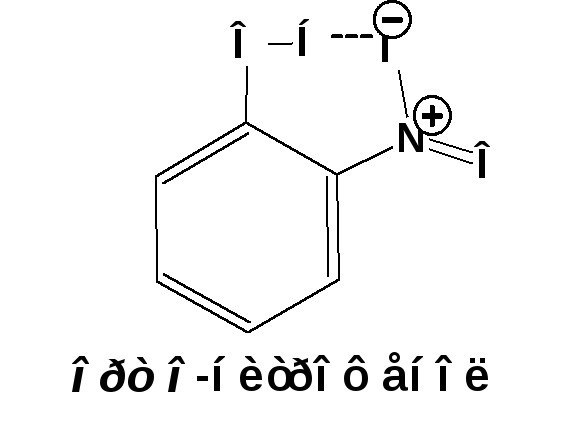
Два полученные изомера существенно различаются по своим свойствам. В отличие от пара-изомера, орто-нитрофенол не растворяется в воде, имеет более низкую температуру кипения и перегоняется с водяным паром. Эти особенные свойстваорто-нитрофенола обусловлены наличием внутримолекулярной водородной связи:
Ориентация электрофильного замещения в орто-положение характерно для фенола. Так сульфирование фенола при температуре 15-200С приводит к образованиюорто-фенолсульфокислоты, а при температуре 1000С образуетсяпара-фенолсульфокислота:

Различие условий указывает, что орто-фенолсульфокислота явяляется продуктом кинетически контролируемым, а образованиепара-фенолсульфокислоты контролируется термодинамически.
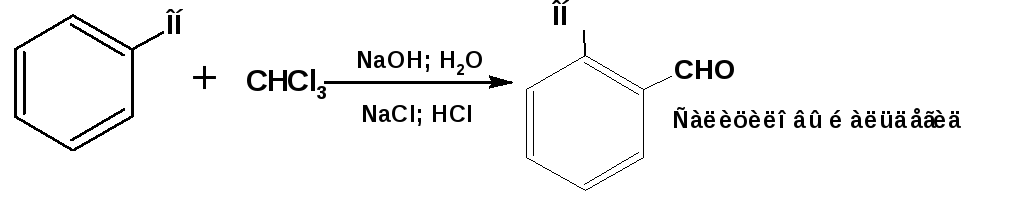
Реакция Реймера-Тимана:
При взаимодействии фенола со щелочным раствором хлороформа образуется салициловый альдегид:
Реакция Кольбе-Шмитта
При взаимодействии сухого фенолята натрия с углекислым газом образуется салициловая кислота:

Реакция с формальдегидом
Фенолы легко конденсируются с формальдегидом (а также уксусным альдегидом, бензальдегидом, фталевым ангидридом, ацетоном) в присутствии кислот или щелочей. Конденсация с формальдегидом проходит по следующему механизму:
 При
низкой температуре образуется полимер
линейного строения, замещение только
в орто-положение. При высокой температуре
образуются продукты пара-замещения что
приводит к пространственной сшивке
полимера. Таким образом, получают
фненолформальдегидные смолы.
При
низкой температуре образуется полимер
линейного строения, замещение только
в орто-положение. При высокой температуре
образуются продукты пара-замещения что
приводит к пространственной сшивке
полимера. Таким образом, получают
фненолформальдегидные смолы.
Окисление
При окислении фенола пероксидом водорода в присутствии железного катализатора образуется пирокатехин:

При действии хромовой кислоты на фенол и гидрохинон образуется п-бензохинон, из пирокатехина получаетсяо-бензохинон:

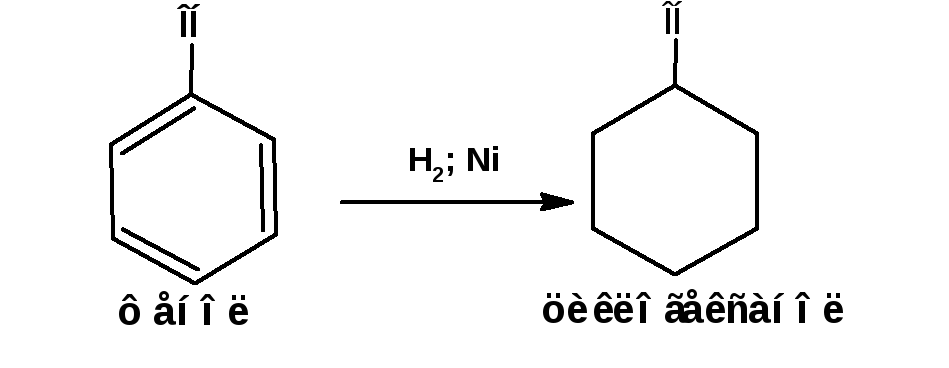
Восстановление
При гидрировании водородом в присутствии катализатора фенолы превращаются в спирты, производные циклогексана: