
- •Лекция 10 спирты и фенолы
- •1. Одноатомные спирты
- •1.1. Классификация, номенклатура, изомерия.
- •1.2. Способы получения
- •1.2.1. Из алкенов
- •1.2.2. Из галогенопроизводных.
- •1.2.3. Синтез спиртов с использованием реактива Гриньяра.
- •1.2.4. Восстановление карбонильных соединений.
- •1.3. Физические свойства
- •1.4. Химические свойства
- •1.4.1. Реакции с разрывом связи о-н Кислотно-основные свойства
- •1.4.1.1. Этерификация кислотами
- •1.4.2.1.Реакции с галогеноводородами
- •1.4.2.2. Реакции с галогенидами фосфора и серы
- •1.4.3. Окисление
- •1.4.4. Восстановление
- •2. Многоатомные спитры
- •2.1. Классификация, номенклатура, изомерия.
- •2.2. Способы получения.
- •2.3. Физические и химические свойства
- •2.3.1. Образование солей с металлами
- •2.3.2. Образование сложных эфиров
- •2.3.3. Дегидратация
- •3.2. Физические свойства
- •3.3. Химические свойства
2.3.1. Образование солей с металлами
Со щелочными металлами гликоли и глицерин образуют полные и неполные гликоляты: СН2ОNа-СН2ОNа, СН2ОNа-СН2ОН и глицераты СН2ОNа-СН2ОNа-СН2ОNа,
СН2ОNа-СН2ОН-СН2ОNа.
Гликоли и глицерин могут реагировать с гидроокисями тяжелых металлов с образованием комплексных соединений:

2.3.2. Образование сложных эфиров
С минеральными и органическими кислотами гликоли и глицерин образуют сложные эфиры. При этом в образовании сложноэфирной системы могут участвовать одна или несколько гидроксильных групп. Т.е. образуются полные и неполные эфиры. Например:

Полный азотнокислый эфир глицерина – глицеринтринитрат (тривиальное название тринитроглицерин) – взрывчатое вещество, на основании которого изготавливаются динамит и пороха.
Для глицерина характерно образование сложных эфиров с карбоновыми кислотами. Например, с уксусной кислотой:

Неполные эфиры будут называться моноацетат и диацетат.
2.3.3. Дегидратация
Отщепление воды от гликолей может иметь внутримолекулярный и межмолекулярный характер. Примеры внутримолекулярной дегидратации:

Отщепление воды от глицерина соответствует дегидратации 1,2-гликоля и 1,3-гликоля:

Примеры межмолекулярной дегидратации:

2.3.4. Окисление
Этиленгликоль окисляется до щавелевой кислоты. В качестве промежуточных продуктов образуются гликолевый альдегид и глиоксаль.
Глицерин окисляется до мезоксалевой кислоты. В качестве промежуточного продукта образуется глицериновый альдегид.
3.ФЕНОЛЫ
Ароматические гидроксисоединения – производные ароматических углеводородов – разделяются на две большие группы: фенолы и ароматические спирты
Ароматические гидроксисоединения, в которых гидроксильная группа связана с ароматическим ядром, называются фенолами.
3.1. Классификация, номенклатура.
Тривиальное название «фенол» принято в номенклатуре ИЮПАК. По числу гидроксильных групп фенолы разделяются на одноатомные, атомные и т.д., для бензола возможны шестиатомные:

3.2. Способы получения
1. Сплавление со щелочами:
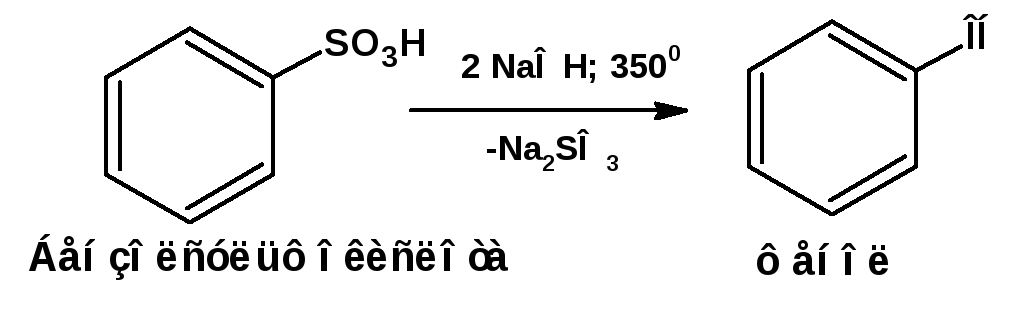
этот метод широко применяется в промышленности. Реакцию ведут при 320-3500С. Более вывысокие выхода получаются при применении едкого кали.
2. Гидролиз галогенопроизводных. Например, получение фенола из хлорбензола:

Процесс ведут в присутствии солей меди.
3. Разложение гидропероксидов:
Самый выгодный способ получения фенола основан на кислотном разложении гидропероксида изопропил бензола (кумола):

4. Окислительное декарбоксилирование карбоновых кислот.
Реакцию проводят при 200-3000С в присутствии солей меди (II):

5. Действие на первичные ароматические амины азотистой кислотой и дальнейший гидролиз образовавшейся соли диазония:

6. Гомологи фенола можно получить аналогичными реакциями из сульфо- галогено- или аминопроизводных гомологов бензола. Гомологи также можно получать алкилированием фенола.
3.2. Физические свойства
Фенолы обычно являются кристаллическими веществами, малорастворимые в воде. Хорошо перегоняются с водяным паром. Обладает характерным запахом. Являются антисептиками. Сильно ядовиты. При попадании на кожу вызывает ожоги.
