
7791
.pdfМИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
О.В. Кащенко, Е.В. Воробьева, С.В. Кулемина
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
Учебно-методическое пособие
по подготовке к лекциям, практическим, семинарским занятиям (включая рекомендации обучающимся по организации самостоятельной работы)
по дисциплине «Химия воды и микробиология» для обучающихся по направлению подготовки 08.03.01 Строительство,
направленность (профиль) Водоснабжение и водоотведение
Нижний Новгород
2022
1
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
О.В. Кащенко, Е.В. Воробьева, С.В. Кулемина
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
Учебно-методическое пособие
по подготовке к лекциям (включая рекомендации обучающимся по организации самостоятельной работы) по дисциплине «Химия воды и микробиология»
для обучающихся по направлению подготовки 08.03.01 Строительство, направленность (профиль) Водоснабжение и водоотведение
Нижний Новгород ННГАСУ
2022
2
УДК 628.16
Кащенко О.В. / Химия воды и микробиология: учебно-методическое пособие / О.В. Кащенко, Е.В. Воробьева, С.В. Кулемина; Нижегородский государственный архитектур- но-строительный университет. – Нижний Новгород: ННГАСУ, 2022. – 29 с. – Текст: электронный.
Приведены указания по подготовке к лекциям (включая рекомендации обучающимся по организации самостоятельной работы) по дисциплине «Химия воды и микробиология», рассмотрены содержание и последовательность подготовке к лекциям, практическим, семинарским занятиям.
Предназначено для обучающихся в ННГАСУ по подготовке к лекциям (включая рекомендации обучающимся по организации самостоятельной работы) по дисциплине «Химия воды и микробиология» направлению подготовки 08.03.01 Строительство, направленность (профиль) Водоснабжение и водоотведение.
© О.В. Кащенко, Е.В. Воробьева, С.В. Кулемина, 2022
© ННГАСУ, 2022
3
СОДЕРЖАНИЕ
Стр.
Введение……………………………………………………………………. 5
1.Физико-химические свойства воды……………….. ………………… 6
1.1.Агрегатные состояния воды……………………………………. 7
1.2.Аномальные (уникальные) свойства воды……………………... 8
1.3.Химические свойства воды……………………………………... 10
2.Растворы …………………………………………………………….. 12 2.1. Растворимость газов …………………………………………… 13
2.2. Взаимная растворимость жидкостей ………………………… 14
2.3.Растворимость твердых веществ………………………………... 16
2.4.Выражение концентрации растворов ……………………….. 17
2.5.Общие свойства растворов……………………………………... 17
3.Характеристика природных вод…………………………………… 19
3.1.Примеси в природных водах…………………………………. 19
3.2.Биологическое загрязнение воды ……………………………. 20
Список литературы………………………………………………….. 28
4
ВВЕДЕНИЕ
Под химическим составом воды понимают весь сложный комплекс веществ, присутствующих в воде в истинно растворенном, коллоидном и взвешенном состоянии. В ее состав входят растворенные газы, различные минеральные и органические вещества, а также микроорганизмы.
Состав воды природных поверхностных источников непостоянен. В них непрерывно происходят процессы окисления, восстановления, а также биохимические процессы. Очень сильно состав природных поверхностных вод зависит от сезона года, от количества выпавших атмосферных осадков, а также от попадания в источники сточных вод. Подземные природные воды подвержены значительно меньшим колебаниям.
Изучение химического состава воды является важной задачей при проектировании и эксплуатации водопроводных очистных сооружений и выборе основных технологических процессов водоподготовки. Перечень контролируемых показателей качества воды определяется требованиями потребителя.
Особые требования предъявляются к качеству питьевой воды, которое регламентируются СаНПиН 2.1.3685-21.
Качество воды оценивается по физическим, химическим и микробиологическим показателям.
К физическим показателям относятся температура, вкус, запах, мутность, цветность, взвешенные вещества.
При химическом анализе воды определяют ее активную реакцию, растворенные в воде газы, катионы, анионы, металлы, органические соединения, жесткость, кислотность, щелочность, перманганатную (ПО) и бихроматную (ХПК) окисляемости.
Микробиологический анализ включает определение общего микробного числа(ОМЧ), наличие термотолерантных колиформных бактерий (ТКБ), общих колиформных бактерий (ОКБ) и колифагов.
Для получения достоверных результатов необходимо соблюдать изложенные в нормативных документах требования к проведению анализа и к качеству применяемых реактивов.
5

1. Физико-химические свойства воды
Вода, что это?
“Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни: ты – сама жизнь.
Антуан де Сент-Экзюпери
(Планета людей, VII. В сердце пустыни)
Вода – уникальное вещество:
Уникальные свойства воды определяются особенностями строения ее молекулы. Впервые состав воды был установлен основоположником современной химии Анту-
аном Лавуазье в 1783 г.
Содержание кислорода и водорода в воде как соотношение 1:2 было установлено Александром фон Гумбольтом и Жозефом Гей-Люссаком в 1805 г.
Вода – это оксид водорода (бинарное неорганическое соединение с химической формулой Н2O).
Молекулярная масса воды равна 18,016 а.е.м. Атомы водорода присоединены к атому кислоро-
да, образуя угол 104,45°.
Связи H–О ковалентные полярные, электронная плотность смещена к атому кислорода. Поэтому атом
кислорода способен притягивать атом водорода со-
седней молекулы воды, образуя водородную связь. Нескомпенсированные заряды на атоме кислорода
можно условно представить расположенными в вершинах частично искаженного тетраэдра.
Это позволяет образовывать кристаллические решетки в твердом состоянии и сохранять эту структуры в талой воде.
Особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают возможность образования особых структур-ассоциатов (кластеров). Вода, состоящая из
множества кластеров различных типов, образует иерархическую пространственную жидкокристаллическую структуру, которая может воспринимать и хранить огромные объемы информации.
Когда говорят, что молекулярный вес воды равен 18 единицам, речь идет о протиевой воде, в состав которой входит стабильный изотоп водорода с массовым числом 1.
6
Кроме обычной воды в природе существует так называемая тяжелая (дейтериевая) вода:
Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода – дейтерия. Формула тяжёловодородной воды обычно записывается как D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная – бесцветная жидкость без вкуса и запаха.
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что ученый был удостоен Нобелевской премии по химии в 1934 году. А уже в 1933 году Гилберт Льюис в Калифорнийском университете США выделил чистую тяжёловодородную воду.
Вприродных водах один атом дейтерия приходится на 6400 атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO, одна такая молекула приходится на 3200 молекул лёгкой воды.
Молекулярная масса дейтериевой воды 20,027.
Взначительных концентрациях дейтериевая вода – яд для высших животных и рас-
тений.
Точка плавления |
3,81 °C (276,97 K) |
Точка кипения |
101,43 °C (374,55 K) |
Из атмосферы в первую очередь конденсируются пары тяжелой воды, поэтому на материковую часть выпадают более облегченные осадки. То же явление наблюдается в горах – в низовьях дейтерия больше.
1.1. Агрегатные состояния воды
Вода это единственное из веществ на Земле, находящееся одновременно в трех агрегатных состояниях: твердое (лед), жидкое (основная часть воды на планете), газообразное
(пар).
Жидкая вода.
Это смесь структурных образований, то есть, в жидкой воде сохраняются элементы ажурной структуры кристаллической молекулярной решетки льда, пустоты в которых частично заполнены одиночными молекулами воды.
Твердая вода (лед).
Переход протиевой воды в твердое состояние происходит при 00С при этом каждая молекула воды образует водородные связи с четырьмя другими молекулами воды – с тремя из того же слоя и одной из соседнего, вследствие чего образуются пустоты, размеры которых больше размера молекулы воды.
При замерзании объем воды возрастает на 11 % и в замкнутом пространстве увеличение объема приводит к избыточному давлению до 2500 атм.
Плотность льда при 0°С составляет 0,9168 г/см3.
7
Газообразная вода (пар).
У воды максимальная теплота испарения по сравнению с другими жидкостями. Водяной пар состоит в основном из одиночных молекул, но в нем встречаются и ас-
социированные молекулы (ди- и тримеры).
1.2.Аномальные (уникальные) свойства воды
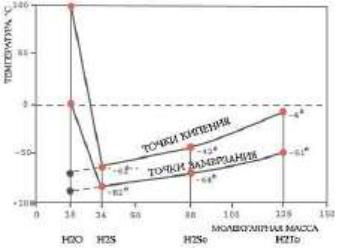
“Ненормальные” температуры плавления (0 °С) и кипения (+100 °С) воды.
Если сравнить воду с аналогичными водородными соединениями (гидридами) подгруппы кислорода периодической системы элементов Д.И. Менделеева (серы, селена, теллура), то вода должна была бы кипеть при температуре –80 °С и замерзать при –100
°С.
Только вода имеет в твердом состоянии плотность меньшую, чем в жидком.
При охлаждении до +3,98 °С вода ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. При дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме на 11%. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Высокое поверхностное натяжение
Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Вода имеет наибольшую теплоёмкость среди жидкостей – 4,1868 кДж/кг
Теплоемкость воды почти в 2 раза выше, чем у растительных масел, ацетона, фенола, глицерина, спирта, парафина, в 10 раз больше теплоемкости железа и в 30 раз больше ртути.
Для превращения в пар 1 г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
С поверхности морей, океанов, суши испаряется за год 520000 км3 воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
8
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких – солнце испепелило бы все живое.
Наличие «температурной ямы»
У воды от 0оС до 37оС теплоёмкость снижается, а с 37оС и выше – растёт. Т.е. легче всего она нагревается и быстрее всего охлаждается при температуре 37оС.
Эта особенность пока не объяснена, однако совпадение с нормальной температурой здорового человека (36,6оС –37,0оС) невольно наводит на размышления.
Именно при температуре 36,6оС –37,0оС сложнейшие реакции обмена веществ в организме человека наиболее интенсивны.
Предположим, если бы вода не обладала этим удивительным качеством, что бы произошло с человеком, состоящим на 70% из воды. Тогда бы просто столь высокоорганизованная система не была защищена от воздействия высоких температур. Вряд ли целебные свойства бани-сауны были бы здесь уместны. Уже при 42оС белок необратимо разрушается. Остаётся только восхищаться, что вода снабдила человека наилучшим режимом теплового саморегулирования.
Вода сохраняет кристаллическую структуру и в жидком состоянии
При комнатной температуре «свободных» молекул воды, т.е. не занимающих определенные места в кристаллической структуре содержится всего 0,1–0,2%. Вода как бы имеет две точки плавления: при 0 оС и при 30–40 оС, когда под влиянием теплового возмущения исчезает ее кристаллическая структура.
Возможно, что это свойство воды делает ее носителем жизни в организме. 42оС – последняя отметка на медицинском термометре. Человек не может жить при температуре тела выше 42 оС, т.е. температуре при которой вода теряет кристаллическую структуру.
Наличие у воды «памяти»
Гомеопатия (альтернативная официальной медицине) утверждает, что разбавленный раствор лекарственного препарата может оказывать лечебный эффект на организм, даже если коэффициент разбавления настолько велик, что в растворе уже не осталось ничего, кроме молекул воды. Сторонники гомеопатии объясняют этот парадокс концепцией под названием «память воды», согласно которой вода на молекулярном уровне обладает «памятью» о веществе, некогда в ней растворенном и сохраняет свойства раствора первоначальной концентрации после того, как в нём не остается ни одной молекулы ингредиента.
Аномальное поведение воды, связанной с клеточными мембранами живых организмов.
В живых клетках обычная вода, будучи связанной с мембранами, неизвестным образом превращается в воду со структурой льда.
При этом кардинально меняются ее свойства, нарушающие законы физики: диэлектрическая проницаемость уменьшается в десять раз, а теплопроводность возрастает в семьдесят раз.
9
1.3. Химические свойства воды
Природная вода (даже самая чистая!) – это водный раствор!
До сегодняшнего дня химически чистую воду получить не удалось!!!
Немецкий химик В.Ф. Кольрауш подвергал воду 42 циклам дистилляции, используя сосуды, с которыми работал до этого опыта в течение 10 лет.
Он предполагал, что из стенок сосуда в выпариваемую воду ничего не попадет. Степень чистоты воды Кольрауш определял по электропроводимости, которая в ре-
зультате оказалась в 100 раз больше, чем у монодистиллированной (один цикл дистилляции) воды.
В дистиллированной воде сразу же растворяются газы окружающего воздуха и частицы стенок сосуда.
А почему В.Ф. Кольрауш использовал электропроводность? Он исходил «от обратного»! Химически чистая вода (которую не удалось получить!) плохо проводит электрический ток, т.е. обладает некоторой электропроводностью.
Вода способна диссоцировать:
H2O ↔ H+ + OH-
По величине электропроводности было вычислено, что при 18 оС в 10 млн. л воды в диссоциированном состоянии находится 0,86 моля воды; при 22 оС – 1 моль воды; при 25 оС – 1,109 моль воды.
В воде есть и «собственные» примеси!
При обычной температуре из каждого миллиарда молекул воды образуется два иона
– Н+ (ион водорода) и ОН (гидроксид-ион).
Ион Н+ немедленно присоединяется к молекуле воды, образуя ион гидроксония Н3О+:
2H2O(ж.) = H3O+(водн.) + OH-(водн.)
Вода – термически устойчива. Выдерживает нагревание до 1000 °С и только при температуре выше 1000 °С частично разлагается на водород и кислород: (почему?)
2H2O ↔ 2H2 + O2
Даже при 2000° С распадается лишь 2% воды.
Вода – катализатор многих химических реакций. Иногда для начала реакции необходимы ее следы. Например, для реакции фтористого водорода со стеклом или хлора – с металлом.
Вследствие полярности молекул вода участвует во множестве химических реакций в качестве растворителя, реагента либо продукта. Вода является продуктом многих неорга-
10
