
5832
.pdf
11
Лабораторная работа №3.
Определение эквивалентной массы металла.
Цель работы: экспериментальным путем определить эквивалентную массу
магния.
В основе одного из экспериментальных методов определения эквивалентной массы металлов, вытесняющих из кислот водород, лежит реакция между навеской
металла и избытком кислоты.
Mg + 2 HCl = MgCl2 + H2
Измерив объем выделившегося водорода, его давление и температуру
вычисляют эквивалентную массу металла. |
|
По закону эквивалентов: nM = nH2 |
или |
Находим:
(12)
Массу водорода вычисляем из уравнения Менделеева-Клапейрона:
(13)
Подставив mH2 из уравнения (12) в уравнение (13), получим:
(14)
Экспериментальная часть.
1. В короткое колено сосуда 1, изображенного на рисунке 2, помещают навеску магния, а в длинное колено избыток соляной кислоты (15 мл 15 % раствора). Сосуд закрываем пробкой с резиновой трубкой, соединяющей сосуд 1 с измерительной бюреткой 5.

12
2. Открывают кран 2 и с помощью уравнительной склянки с водой 3
заполняют бюретку до метки 4, совместив уровни воды в измерительной склянке и бюретке. Закрывают кран 2.
3. Осторожно приливают кислоту к магнию небольшими порциями.
4. После окончания реакции сосуд 1
охлаждают до комнатной температуры и
Рис. 3. Схема установки.
измеряют объем выделившегося водорода,
предварительно совместив уровни воды в уравнительной склянке и бюретке.
Определяют температуру и атмосферное давление.
Из экспериментальных данных:
mм - масса магния (г),
VH2 - объем выделившегося водорода (л),
Р - атмосферное давление (атм),
Т - температура (К),
R - универсальная газовая постоянная
(для расчетов выбираете наиболее удобные единицы),
по уравнению (14) находят Эм.
Относительную погрешность измерения вычисляют по формуле:
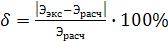 ,
,
где: Ээкс.- эквивалентная масса магния, вычисленная из экспериментальных данных;
Эрасч.- эквивалентная масса магния, рассчитанная по формуле (4).
ВЫВОД
1.Получено экспериментальное значение Эмg, равное ........................
2.Относительная ошибка измерения составила ................................. %.
13
Лабораторная работа №4.
Определение эквивалентной массы карбоната кальция.
Цель работы: определить эквивалентную массу карбоната кальция по его взаимодействию с соляной кислотой.
Простые и сложные вещества взаимодействуют друг с другом в эквивалентных количествах, т.е. с 1 эквивалентом одного вещества реагирует строго 1 эквивалент другого вещества. Таким образом, число эквивалентов и эквивалентная масса соединения могут быть найдены экспериментальным путем.
Экспериментальная часть.
1.Взвесить на технических весах чистый пустой стакан емкостью 50-100 мл (масса m1).
2.Поместить в стакан несколько кусочков мрамора (СаСО3) и вновь взвесить
(масса m2). Определяем массу взятого мрамора m2 - m1. Она должна быть в пределах
1,5-3,0 г.
3.Отмерить мерным цилиндром 15 мл 1 н раствора HCl. Осторожно прилить кислоту к мрамору. Какая реакция происходит между взятыми веществами? Запишите уравнение реакции.
4.Когда выделение пузырьков газа заметно уменьшится нагреть стакан до 6080оС на электрической плитке. Выделение пузырьков в первый момент несколько увеличится, затем прекратиться, что будет свидетельствовать о завершении реакции.
5.Слить раствор с оставшихся кусочков мрамора и промыть их два раза дистиллированной водой.
6.Оставшиеся капельки воды в стакане и на кусочках мрамора промокнуть фильтровальной бумагой и подсушить
7.Стакан с сухими кусочками мрамора взвесить на технических весах (масса
m3).
|
|
|
14 |
|
|
|
|
8. Данные |
опыта записать в следующей форме: |
|
|||||
|
|
|
|
|
|
|
|
Кислота |
|
Масса стакана (г) |
|
Масса мрамора (г) |
|||
|
|
|
|
|
|
|
|
V (мл) |
пустого |
с мрамором |
с мрамором |
до |
|
после |
прореагиров |
|
|
(до опыта) |
(после опыта) |
опыта |
|
опыта |
авшего |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
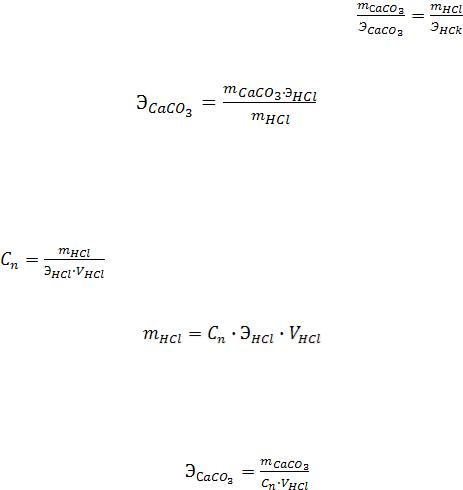
9. По полученным экспериментальным данным вычисляют эквивалентную массу
карбоната кальция. |
|
По закону эквивалентов: nСаСО3 = nHCl |
или |
Находим: |
|
|
(15) |
где: m СаСО3 - масса прореагировавшего мрамора;
Э HCl - эквивалентная масса HCl, рассчитывается по формуле (5);
m HCl - массу HCl находят из формулы для эквивалентной концентрации:
отсюда: |
|
, |
(16) |
где: V HCl - объем взятого раствора кислоты в литрах (0,015 л).
Подставляем m HCl из уравнения (16) в (15) и получаем:
(17)
10. Относительную погрешность измерения вычисляют по формуле:
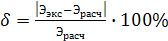 ,
,
|
|
15 |
|
где: Ээкс.- эквивалентная масса |
СаСО3, вычисленная из |
||
экспериментальных данных по формуле (17); |
|
||
|
Эрасч.- эквивалентная масса СаСО3, рассчитанная по формуле (8). |
||
|
|
ВЫВОД |
|
1. |
Получено экспериментальное значение Э СаСО3, равное |
........................ |
|
2. |
Относительная ошибка измерения составила ................................. |
%. |
|
16
ЗАДАНИЯ.
1. Дайте определение молярной и эквивалентной массе вещества.
2.Молярная и эквивалентная масса являются свойством:
а) экстенсивным б) интенсивным
3.Сколько электронных пар участвует в образовании всех связей Al2O3
O = Al –O – Al = O
4. Вычислите количества вещества О2 в молях и эквивалентах, если его масса 48
г.
5.Вычислите молярную и эквивалентную массу FeO, Fe2O3 и железа в этих соединениях.
6.Вычислите эквивалентную массу веществ H2SO4, H3PO4, Na2CO3, Ca3(PO4)2.
7.0,2 эквивалента HCl прореагировали с 10 г CaCO3. Вычислите ЭCaCO3.
8.7 г HCl прореагировали с 10 г CaCO3. Вычислите ЭCaCO3.
9.Вычислите массу СО2, выделившегося при взаимодействии 0,2 экв HCl с
избытком CaCO3.

17
Тест 1 |
|
|
|
|
|
|
|
|
|
1. |
Наименьшую массу (в граммах) имеет 1 моль вещества |
||||||||
1) |
Cs2O; |
|
2) Cl2O; |
|
3) N2O; |
4) Cu2O. |
|||
2. |
Число молекул в 104,4 г хлорида бария равно |
||||||||
1) |
3,02·1023; |
|
2) 6,04·1022; |
3) 1,2·1023; |
4) 2,4·1023 |
||||
3. |
Какая формула правильно выражает закон эквивалентов: |
||||||||
1) |
|
|
|
|
|
2) m1∙Э2 = m2∙Э1 |
|
||
4. |
Эквивалентная масса Fe2(SO4)3 находится по формуле: |
||||||||
1) |
; |
2) |
; |
3) |
; |
4) . |
|
|
|
5. |
Сплавили 10 г кальция и 10 г углерода, в результате образовался карбид |
||||||||
кальция СаС2. В результате реакции получилось |
|
||||||||
1) |
16 г СаС2, в остатке 4 г углерода |
2) 20 г СаС2,остатка нет |
|||||||
3) |
16 г СаС2, в остатке 4 г кальция |
4) 20 г СаС2, в остатке 4 г углерода |
|||||||
Тест 2 |
|
|
|
|
|
|
|
|
|
1. |
Относительная молекулярная масса равна 95 для хлорида |
||||||||
1) |
кальция; |
|
2) бария; |
|
3) бериллия; |
4) магния. |
|||
2. |
Количества вещества (моль) в порции оксида калия, содержащей 3,61·1023 |
||||||||
молекул, равно |
|
|
|
|
|
|
|
||
1) |
0,3; |
|
2) 0,6; |
|
3) 1,2; |
|
4) 6,68. |
||
3. |
Эквивалент вещества – такое его количество, которое соединяется с: |
||||||||
1) |
12 г |
; |
|
|
|
3) 1 моль атомов водорода; |
|||
2) |
1 моль водорода (н.у.); |
4) 1 моль атомов кислорода. |
|||||||
4. |
Эквивалентная масса AlCl3 |
находится по формуле: |
|||||||
1) |
; |
2) |
; |
3) |
; |
4) . |
|
|
|
5. |
При реакции 20 г железа и 15 г серы получился сульфид железа. При этом |
||||||||
образовалось |
|
|
|
|
|
|
|
|
|
1) |
31,4 г FeS, остатка нет; |
|
|
2) 35, г FeS, остатка нет; |
|||||
18
3) 31,4г FeS, в остатке 3,6 г серы; 4) 31,4 г FeS,в остатке 3,6 г железа.
19
ЛИТЕРАТУРА.
1.Глинка, Н.Л. Общая химия / Н.Л. Глинка. – М.: Интеграл-Пресс, 2003. –728 с.
2.Зайцев, О.С. Общая химия. Состояние веществ и химические реакции / О.С.
Зайцев. – М.: Химия, 1990. – 352 с.
3. Зайцев, О.С. Общая химия. Направление и скорость химических процессов.
Строение вещества / О.С. Зайцев. – М.: Высшая школа, 1983. –264 с.
4. Ахметов, Н.С. Общая и неорганическая химия. Учеб. Для вузов / Н.С.
Ахметов. – М.: Высш. шк.; 2002. – 743 с.
5. Глинка, Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / Н.Л. Глинка. Под ред. В.А. Рабиновича и Х.М. Рубинной. –М.: Интеграл-Пресс,
2002. –240 с.
6. Зайцев, О.С. Задачи и вопросы по химии / О.С. Зайцев. – М.: Химия, 1985. –
304 с.

20
Митрофанова Светлана Валерьевна Смельцова Ирина Леонидовна
ХИМИЧЕСКИЕ ЕДИНИЦЫ
КОЛИЧЕСТВА ВЕЩЕСТВА
Учебно-методическое пособие по подготовке к лекциям и выполнению лабораторных работ по дисциплине «Химия
и материаловедение» для обучающихся по направлению подготовки 27.03.05 Инноватика,
профиль Управление инновациями
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
603950, Нижний Новгород, ул. Ильинская, 65. http://www. nngasu.ru, srec@nngasu.ru
