
4966
.pdfМинистерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Нижегородский государственный архитектурно-строительный университет»
И.Л. Смельцова
РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ
Учебно-методическое пособие к выполнению лабораторных работ Химия
(общая, неорганическая, органическая химия) для студентов ННГАСУ направления подготовки 20.03.01 Техносферная безопасность, направленность
(профиль) Безопасность технологических процессов и производств
Н. Новгород
2018
2
УДК 543(075)
Смельцова И.Л. Реакции комплексообразования.: учеб. - метод. пос. / И.Л.
Смельцова, Нижегор Нижегор. гос. архитектур.-строит. ун-т -Н.Новгород:
Издание ННГАСУ, 2018. – 25 c.
В сжатой форме изложены теоретические основы реакции комплексообразования, методы получения комплексных соединений и изучения их свойств, а также варианты контрольных заданий.
Предназначено обучающимся в ННГАСУ для выполнения лабораторных работ по общей и неорганической химии для студентов 1 курса, направление
20.03.01 Техносферная безопасность, направленность (профиль) Безопасность технологических процессов и производств.
© ННГАСУ, 2018
© И.Л. Смельцова, 2018
3
ВВЕДЕНИЕ Комплексные соединения применяли еще 3500 лет назад в Египте и
Финикии. Для крашения тканей использовали природные красители, например,
индиго, пурпур, шафран, кармин, которые получали из различных растений.
Ткань перед покраской пропитывали солями железа, алюминия, хрома, титана,
а затем опускали в раствор красителя. Присутствие металла в материалах значительно повышало интенсивность окраски, ее прочность, а в ряде случаев обуславливало появление окраски. Первые чернила - продукт взаимодействия галловой кислоты, содержащейся в орешках, покрывающих дубовые листья, с
ионами железа (III). При растворении золота в «царской водке» (смесь азотной и соляной кислот 3:1) образуется комплексное соединение H3[AuCl4]. В 1597 г.
Андрей Либавий впервые получил ярко окрашенное в синий цвет комплексное соединение [Cu(NH3)4]SO4. На протяжении 18 в. все чаще появляются сообщения о синтезе необычных соединений. Получены комплексные соединения K[Au(CN)2], K2[HgI4], [Co(NH3)6]Cl3, K3[Fe(CN)6], [Pt(NH3)4][PtCl4] и
другие соединения железа, кобальта, платины. В России в 1897 г.
опубликованы работы А.А. Мусина-Пушкина о получении комплексов платины Mg[PtCl6], Ba[PtCl6]. В 1843 г. П.Б. Багратион опубликовал работу о растворении золота, серебра, меди в цианидах калия и натрия; образуются соединения состава Na[Au(CN)2] и подобные. В 1840 г. К.К. Клаус в Петербурге получил и исследовал десятки комплексных соединений платины, рутения,
иридия с органическими основаниями и аммиаком.
Комплексные соединения в отличие от обычных солей содержат в своем
составе сложный (комплексный) ион. Он как структурная единица вещества существует и в кристаллах, и в растворе комплексного соединения.
Существовавшая в конце 19 века теория валентности не могла объяснить природу связей в комплексных соединениях, хотя над ней работали ведущие ученые того времени А. Кеккуле, Берцелиус, Гофман, Бломстранд, Иергенсон.
По словам русского химика Л.А. Чугаева, к началу 90-х годов химия
4
комплексных соединений «по своей запутанности, по противоречивости фактических данных и отсутствию какой-либо общей руководящей идеи казалась совершенно безнадежной для систематической разработки».
КООРДИНАЦИОННАЯ ТЕОРИЯ ВЕРНЕРА Швейцарский химик Альфред Вернер в 1893 году ввел в химию понятие
комплексного соединения. К комплексным соединениям он относил наиболее устойчивые соединения высшего порядка, которые в водном растворе либо вообще не распадаются на составные части, либо распадаются в незначительной степени.
При записи формул комплексных соединений комплексный ион заключают в квадратные скобки. Например, [Ag(NH3)2]Cl, K2[HgI4], Na3[Al(OH)6],
[Zn(NH3)4]Cl2 и т.д.
В соответствии с координационной теорией А. Вернера, комплексный ион состоит из центрального атома - комплексообразователя и лигандов, которые стремятся равномерно расположиться в пространстве вокруг атома-
комплексообразователя. Это явление Вернер назвал координацией.
Лигандами могут быть ионы с зарядом, противоположным заряду центрального иона-комплексообразователя, или нейтральные молекулы. Число лигандов, координированных вокруг комплексообразователя, назвали координационным числом, или координационной валентностью (КВ).
Координационное число больше степени окисления комплексообразователя.
Известные координационные числа от 1 до 9. Комплексные соединения с координационной валентностью 2, 4 и 6, соответствуют наиболее симметричной геометрической конфигурации комплекса - октаэдрической (6),
тетраэдрической или квадратной (4) и линейной (2). Положение, занимаемое одним лигандом около центрального атома, Вернер определил как координационное место.

5
Комплексный ион образует координационную (внутреннюю) сферу комплексного соединения. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и всех лигандов.
Рис.1. Состав комплексного соединения.
УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ При растворении в воде комплексные соединения диссоциируют
практически нацело (как сильный электролит). Например:
Cu(NH3)4 (OH)2 Cu(NH3)4 2+ + 2OH -.
При диссоциации комплексного иона между ионом-комплексообразовате-
лем, лигандами и комплексным ионом устанавливается равновесие:
Cu(NH3)4 2+ ↔ Cu2+ + 4NH3 (вторичная диссоциация).
Комплексный ион диссоциирует обратимо (как слабый электролит) и процесс диссоциации может быть охарактеризован константой равновесия, называемой константой нестойкости комплексного иона:
|
С |
2 C4 |
|
Кнест |
Cu |
NH 3 |
(1) |
|
|
||
|
C Cu ( NH 3 ) 4 2 |
||
6
Это так называемая полная константа нестойкости. Так как диссоциация комплексного иона происходит ступенчато, то каждую ступень, можно охарактеризовать ступенчатой константой нестойкости:
2+ |
|
|
2+ |
|
|
|
С Cu ( NH 3 )3 2 |
CNH 3 |
|||||
[Cu(NH3)4] |
↔ [Cu(NH3)3] |
+ NH3; |
К |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
1 |
|
|
|
C Cu ( NH 3 )3 2 |
||||
|
|
|
|
|
|
|
|
|
|||||
2+ |
|
|
2+ |
|
|
|
C Cu ( NH 3 ) 2 2 |
CNH 3 |
|||||
[Cu(NH3)3] |
↔ [Cu(NH3)2] |
+ NH3; |
K2 |
|
|
|
|
|
|
|
|
||
|
|
C Cu ( NH 3 )3 2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
(2) |
|||
2+ |
|
|
2+ |
|
|
|
|
|
C Cu ( NH 3 ) 2 |
CNH 3 |
|||
[Cu(NH3)2] |
↔ [Cu(NH3)] |
+ NH3; |
K3 |
|
|
|
|
|
|
|
|
||
|
|
C Cu ( NH 3 ) 2 2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||
2+ |
|
2+ |
|
|
|
|
|
CCu 2 CNH 3 |
|
|
|
|
|
[Cu(NH3)] |
↔ Cu |
|
+ NH3; |
|
K4 |
|
|
|
|
|
|
|
|
|
|
|
|
C Cu ( NH 3 ) 2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полная константа нестойкости (Кнест.) равна произведению ступенчатых констант нестойкости:
|
|
|
|
|
|
|
|
|
С |
2 C4 |
|
К |
|
К К |
|
К |
|
К |
|
|
Сu |
NH 3 |
(3) |
нест |
2 |
3 |
4 |
|
|
||||||
|
1 |
|
|
|
C Cu NH 3 4 2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
||
В табл.1 приведены значения констант нестойкости некоторых комплекс-
ных ионов.
7
Таблица 1
Значения констант нестойкости некоторых комплексных ионов
Комплексный ион |
Кнест. (298 К) |
|
|
[Ag(NH3)2]+ |
6,8·10-8 |
|
|
[Ag(CN)2]- |
1,0·10-21 |
|
|
[Cu(NH3)4]2+ |
4,6·10-14 |
|
|
[Co(NH3)6]2+ |
8,0·10-6 |
|
|
[Co(NH3)6]3+ |
8,0·10-36 |
|
|
[Fe(CN)6]3- |
1,0·10-44 |
|
|
[Fe(CN6)]4- |
1,0·10-37 |
|
|
[Zn(NH3)4]2+ |
4,0·10-10 |
|
|
[Zn(CN)4]2- |
6,8·10-18 |
|
|
[FeF6]3- |
1,7·10-3 |
|
|
Величина, обратная константе нестойкости, называется константой комплексообразования.
Устойчивость комплексного иона в растворе зависит от прочности связи между комплексообразователем и лигандами. В свою очередь прочность связи зависит от природы комплексообразователя и лигандов. Чем меньше радиус иона комплексообразователя и чем выше его заряд, тем более прочный комплекс он образует. Наиболее прочные комплексы образуются, если лигандами являются анионы.
ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Внастоящее время природу связей в комплексных соединениях объясняют
спозиций квантово-механической теории строения атомов и молекул. Для описания химической связи в комплексах используют три теоретических подхода: метод валентных связей, теорию кристаллического поля, метод
8
молекулярных орбиталей. Рассмотрим основные положения метода валентных связей.
Связь в комплексе является ковалентной и образуется по донорно-
акцепторному механизму с участием свободных (вакантных) орбиталей иона -
комплексообразователя и неподеленных электронных пар лигандов. Лиганды -
доноры электронных пар, центральный ион-комплексообразователь - их акцептор. Электронные пары лигандов, поступая на свободные гибридные орбитали, центрального атома, становятся общими.
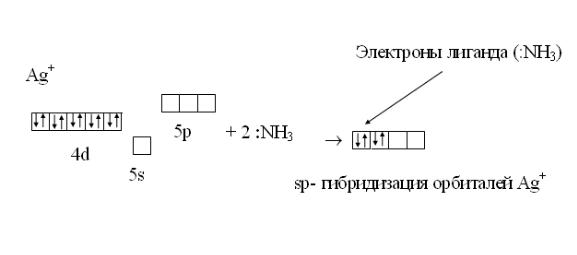
Рассмотрим применение метода валентных связей для описания строения комплекса [Ag(NH3)2]+:
Электронная формула атома Ag: 1s22s22p63s23p63d104s24p64d105s15p5d Электронная формула иона Ag+: 1s22s22p63s23p63d104s24p64d105s5p5d
Орбитали пятого квантового уровня иона Ag+ свободны. Это валентные орбитали.
В молекуле аммиака NH3 донорным является атом азота, т.к. имеет неиспользованную на образование связей электронную пару :NH3.
Образование связи в комплексном ионе [Ag(NH3)2]+ изображается схемой:
Геометрическая форма комплекса линейная: H3N :  Ag
Ag  : NH3
: NH3
В комплексном аммиакате никеля (II) в образовании связей участвуют s-, p-, d-орбитали внешнего квантового уровня:
Ni2+ + 6NH3 H2O ↔ [Ni(NH3)6]2+ + 6H2O

9
Электронная конфигурация иона Ni2+: 1s22s22p63s23p63d84s4p4d.
sp3d2 - гибридизация
Энергетические уровни состояний электронов в комплексе выравниваются за счет гибридизации орбиталей. Тип гибридизации определяет пространственную конфигурацию комплекса.
В таблице 2 приведены соотношения координационного числа, типа гибридизации и пространственной конфигурации комплексного иона.
Таблица 2
Виды гибридизации и структуры комплексов
Коорди- |
Тип |
Геометрическая |
|
национное |
гибридиза- |
форма комплекса. |
Комплексообразователь |
число |
ции |
|
|
|
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
2 |
sp |
Линейная |
Hg2+, Ag+ |
|
|
|
|

10
1 |
2 |
3 |
4 |
|
|
|
|
4 |
sp3 |
Тетраэдрическая |
Al3+, Zn2+, Co2+, Fe2+, Ni2+, |
|
|
|
Ti3+, Cu+ |
|
|
|
|
4 |
dsp2 |
плоская квадратная |
Pt2+, Pd3+, Cu2+, Ni2+, Au3+ |
|
|
|
|
6 |
sp3d2 |
Октаэдрическая |
Cr3+, Co3+, Ni2+, Pd4+, Pt4+, |
|
d2sp3 |
|
Co3+, Fe3+, Ti4+, Fe2+, Cr3+ |
|
|
|
|
Свойства комплексного соединения зависят как от природы центрального атома, так и природы лигандов. Наиболее важными характеристиками центрального атома являются: электронная конфигурация, радиус, степень окисления, ионный потенциал (отношение заряда иона к его радиусу). В
зависимости от электронной конфигурации металлы делят на несколько групп.
В одну можно объединить металлы, ионы которых имеют конфигурацию благородного газа ns2np6 и вакантными у них являются орбитали (n+1)
квантового уровня: Be2+, Mg2+, Al3+, Sc3+; лантаноиды, актиноиды со степенью окисления +3; Ti+4, Zr+4, V+5, Nb+5, Cr+6, Mo+2, Mn+7, Re+7, Os+8, Ru+8 и др. Они образуют наиболее прочные комплексы с кислород- и фторсодержащими лигандами.
Такие ионы, как Ag+, Cu+, Au+, Zn2+, Cd2+ , имеют конфигурацию (n-1)d10.
Вакантными у них являются s-, p-, d-орбитали внешнего квантового уровня.
