
4056
.pdf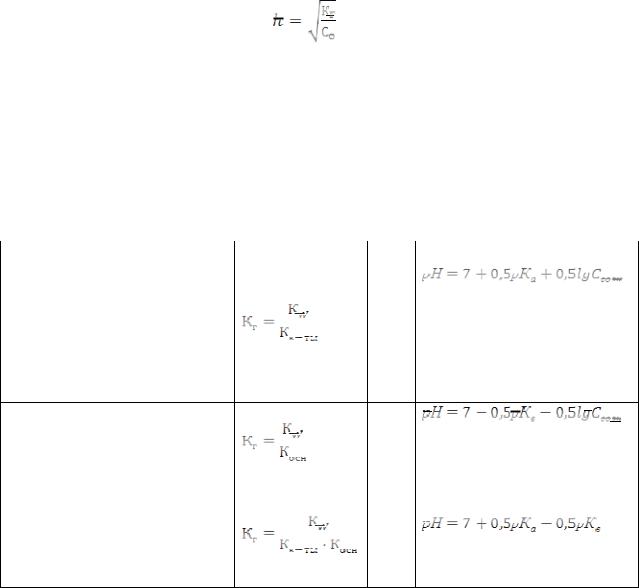
(11)
Из этой формулы видно, что степень гидролиза увеличивается при разбавлении раствора. Степень гидролиза увеличивается также при повышении температуры.
Формулы для расчетов КГ и рН в растворах гидролизующих солей.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип соли |
|
|
|
Кг |
рН Формула для расчета рН |
|||||||||||||||||||
1. |
Соль, |
образованная |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
катионом сильного основания |
> 7 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
и |
анионом |
слабой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(KF, NaClO, Na2S03, К3РО4 и
др.).
2. Соль, образованная катионом
слабого основания и анионом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
< 7 |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
сильной кислоты (NH4C1, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
AgN03, CuSO4, А1С13 и др.). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3. |
Соль, |
образованная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
катионом слабого основания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≈ 7 |
|||||||||
и |
анионом |
слабой кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
(NH4F, СН3СООNH4 и др.). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ЛАБОРАТОРНАЯ РАБОТА №1
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) РАСТВОРОВ
Цель работы: Определить рН растворов электролитов и вычислить концентрацию ионов водорода.
Величину концентрации Н+ и рН измеряют при помощи приборов иономеров. рН-метр состоит из датчика и измерительного устройства. Датчик представляет собой своеобразный гальванический элемент: один электрод его имеет постоянное значение потенциала (электрод сравнения), величина потенциала второго электрода – функция концентрации одного из ионов раствора, в который погружены электроды. Этот электрод называют индикаторным (или измерительным). Электродвижущая сила (ЭДС) такого гальванического элемента – также функция концентрации ионов раствора,

которые участвуют в возникновении скачка потенциала индикаторного электрода. Для измерения концентрации ионов Н+ в растворе в качестве индикаторного используют стеклянный электрод, т.к. потенциал его (ϕст) зависит от концентрации Н+:























 или
или




















 , где
, где
k – константа, зависящая от сорта стекла, из которого изготовлен электрод.
Экспериментальная часть.
1. Начертите таблицу 2.
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
№ |
0,01М раствор |
рНэксп. |
[Н+] |
Уравнение |
рНтеор. |
|
|
|
|
реакции |
|
1. |
H2O |
|
|
H2O ↔ H+ + OH- |
|
2. |
NaCl |
|
|
|
|
3. |
HCl |
|
|
|
|
4. |
CH3COOH |
|
|
|
|
5. |
NH4Cl |
|
|
|
|
6. |
CH3COONH4 |
|
|
|
|
7. |
CH3COONa |
|
|
|
|
8. |
Na2CO3 |
|
|
|
|
9. |
NH4OH |
|
|
|
|
10. |
NaOH |
|
|
|
|
2.Настройте прибор в соответствии с инструкцией к нему (при настройке прибора консультируйтесь с дежурным лаборантом).
3.В 9 нумерованных стаканов налейте по 50 мл 0,01М растворов веществ, приведенных в таблице.
4.Измерьте рН дистиллированной воды. Значение запишите в таблицу 2.
5.Вынув электроды из сосуда с дистиллированной водой, просушите их кусочком фильтровальной бумаги и погрузите их в следующий раствор №2. Измерьте значение рН и запишите в таблицу 2.
6.Выньте электроды из раствора, промойте поверхность электродов дистиллированной водой из промывалки над стаканом «слив» и вновь
просушите фильтровальной бумагой. Сухие электроды погрузите в следующий раствор. Аналогичные операции повторите со всеми растворами.
7.После измерения рН последнего раствора электроды промойте и погрузите в стакан с дистиллированной водой. Выключите прибор из сети.
8.По значениям рН растворов рассчитайте концентрацию ионов Н+ в каждом растворе.
9.Рассчитайте и внесите в таблицу 2 теоретические значения рН растворов. Расчет рН растворов солей производят по формулам таблицы 1, а расчет рН растворов кислот и оснований, с использованием формул 1 – 9.
Выводы
1.Установлено, что в растворах солей среда (кислая, щелочная, нейтральная) . . .
2.рН растворов кислот HCl и CH3COOH резко отличаются при одной и той же концентрации электролита. Это объясняется тем, что . . .
Вопросы.
1.Почему в растворах хлороводородной и уксусной кислот одинаковой молярности концентрация ионов Н+ и рН различные?
2.Как объяснить разный характер среды в растворах используемых солей? Составьте уравнения реакции гидролиза этих солей.
3.Сделайте вывод об особенностях диссоциации сильных и слабых электролитов. Почему в таблице констант диссоциации (см. приложение) нет
HCl, HNO3, HClO4, NaOH, КОН, а для Н2SO4, Ca(OH)2, Ba(OH)2 приведены лишь значения констант ионизации по второй ступени.
ТЕСТ 1
Процессы в водных растворах электролитов
1) В жидкой воде (обычно мы называем ее просто «вода») протекает процесс самоионизации. В результате в воде наряду с молекулами воды, их ассоциатами находятся ионы . . . и . . . равновесные концентрации которых равны………...

2) В чистой жидкой воде и водных растворах любого вещества при стандартной температуре произведение концентрации (точнее активностей) ионов гидроксония и гидроксила равно:
1.10-7;
2.10-14;
3.1,8·10-16.
3) Водородный показатель (рН) раствора рассчитывают по формуле:
1.











2.









3.











4.











4) Для водных растворов справедливо соотношение: |
|
|||||
|
1) рН + рОН = 7; |
2) рН + рОН = 14; |
|
|||
|
3) рН < рОН; |
4) рН > рОН; |
|
|||
5) В таблице приведены значения ионного произведения воды (КW) в |
||||||
зависимости от температуры: |
|
|
|
|||
|
|
|
|
|
|
|
t,°С |
0 |
25 |
|
40 |
60 |
100 |
|
|
|
|
|
|
|
КW |
1,15·10-14 |
1,00·10-14 |
|
3,00·10-14 |
9,50·10-14 |
1,00·10-14 |
|
|
|
|
|
|
|
Процесс самоионизации воды: |
1. Экзотермический; |
|
||||
|
|
|
|
2. эндотермический; |
|
|
При 60°С рН воды: |
1. равен 7; |
|
|
|
||
2.больше 7;
3.меньше 7.
6)Вещества, которые при растворении в воде или в расплавах образуют ионы, называют . . .
К ним относятся: 1. . . .
2. . . .
3. . . .
7) При растворении в воде кислот, оснований и некоторых солей равенство концентраций ионов Н+ и ОН- может нарушаться. Установите соответствие:
Раствор вещества |
рН раствора |
|
1. |
Кислота |
А. > 7 |
2. |
Основание |
Б. < 7 |
3. |
Соль |
В. = 7 |
8) Растворы, рН которых равен 7 называют . . . меньше 7 называют . . .,
больше 7 – . . . |
|
|
|
9) Слабыми электролитами являются: |
|
|
|
1) CrCl3; |
2) H2SO3; |
3) Cr(OH)3; |
4) NH4OH. |
10) Слабым основанием является: |
|
1) NaOH; 2) Ca(OH)2; 3) Fe(OH)3; |
4) LiOH. |
11) Сильными кислотами являются: |
|
|
|
1) НCl; |
2) H3РO4; |
3) HF; |
4) HI. |
12) Установите соответствие:
Водный раствор вещества |
рН раствора |
|
1. H2SO4 |
A. 7 |
|
2. |
(NH4)2SO4 |
|
3. K2CO3 |
Б. меньше 7 |
|
4. |
AlCl3 |
|
5. |
(NH4)2S |
В. больше 7 |
6. Na2S |
|
|
7. |
NaI |
|
8. |
KCl |
Г. близко к 7 |
9. NH4OH |
|
|
10. Ca(OH)2 |
|
|

13)Водородные показатели (рН) для растворов NH4OH (1) и NaOH (2)
содинаковой молярной концентрацией:
1. равны в обоих растворах; |
2. в растворе 1 больше чем в 2; |
3. в растворе 1 меньше чем в 2; |
4. нельзя определить. |
14) Приготовлены 0,01М растворы веществ. Установите соответствие:
|
0,01М раствор веществ |
рН |
1. NaOH |
А. 2 |
|
2. NH4OH |
Б. 5 |
|
3. |
HCl |
В. 7 |
4. |
NaCl |
Г. 10 |
5. HCN |
Д. 12 |
|
15) Для расчета рН раствора слабой кислоты используют формулу:
1. 
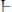











2. 
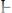


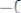
























3. 
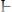



























Где Ккисл – это . . .
рКкисл – это . . .
С0 – начальная концентрация кислоты.
16) В 0,01Н растворе одноосновной кислоты рН=4. Эта кислота:
1. сильная; |
2. слабая; 3. нельзя определить. |
17) Наиболее кислым следует считать раствор, в котором:
1. рН = 0 |
2. рН = 1 |
3. рН = 7 |
4. рН = 10 |
18) Гидролизу не подвергается соль: |
|
||
1. Na2CO3 |
2. Na2SO4 |
3. FeCl3 |
4. ZnCl2 |

19) Гидролизу в водном растворе подвергается соль:
1. NaCl 2. MgCO3 3. Na2SO4 4. КNO3
20) Наиболее щелочным следует считать раствор, в котором: 1. рН = 10 2. рН = 1 3. рН = 7 4. рН = 12
ТРУДНОРАСТВОРИМЫЕ ЭЛЕКТРОЛИТЫ
При растворении труднорастворимых электролитов в воде протекает реакция:
(тв) |
(р-р) |
Раствор, равновесный с твердой фазой растворенного вещества называют насыщенным. Концентрация вещества в насыщенном растворе характеризует его растворимость (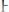





 , моль/л). В справочных таблицах
, моль/л). В справочных таблицах
величину растворимости приводят в граммах растворенного вещества на 100г растворителя.
Константу равновесия реакции растворения труднорастворимого электролита называют произведением растворимости и обозначают символом 






 :
:
(12)
Правило произведения растворимости:
При данной температуре в насыщенном растворе труднорастворимого электролита произведение концентраций ионов, возведенных в степени, равные стехиометрическим коэффициентам, – величина постоянная, называемая произведением растворимости.
Оно справедливо, если единственными продуктами при растворении электролитов являются ионы, а меж-ионные и ионно-молекулярные взаимодействия ничтожно малы (система близка к идеальной).

Концентрация ионов в насыщенном растворе равна:



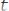








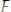






 , моль/л
, моль/л
и |
|
|
|
|
|
|
|
|
|
|
, моль/л , (13) |
|
|
||||||||||
|
|
|
|
|
|
|
где: 






 – растворимость труднорастворимого электролита, моль/л.
– растворимость труднорастворимого электролита, моль/л.
Величина ПР – термодинамическая константа вещества, зависящая только от температуры, если раствор, находящийся в равновесии с осадком (насыщенный раствор), идеален.
ЛАБОРАТОРНАЯ РАБОТА № 2
ОПРЕДЕЛЕНИЕ рН НАЧАЛА ОСАЖДЕНИЯ ГИДРОКСИДОВ МЕТАЛЛОВ
Цель работы: определить величину рН начала осаждения гидроксида кобальта Со(ОН)2. По экспериментальным данным рассчитать 











 .
.
Значение рН при которых начинается выделение осадков малорастворимых гидроксидов металлов, называют рН гидратообразования. Зная эту величину, можно определить ПР М(ОН)2. Величина рН гидратообразования может быть рассчитана и определена экспериментально.
В растворе соли двухвалентного металла при достижении рН гидратообразования устанавливается равновесие:
|
|
|
|
|
|
М2+ + 2ОН- ↔ М(ОН)2(тв) |
||||||||||||
|
|
|
|
|
|
|
|
р-р |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
(14) |
|
||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
Зная, что в растворе |
|
|
|
|
|
|
|
|
|
|
, получим |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
(15) |
|||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Величина рН гидратообразования зависит от концентрации соли. Она зависит так же от посторонних электролитов в растворе. По экспериментальной величине рН можно рассчитать значение 










 .
.
Экспериментальная часть.

Для измерения величины рН гидратообразования и величины произведения растворимости гидроксида кобальта используют потенциометрическое титрование его соли раствором щелочи. Измерительная ячейка состоит из стеклянного (индикаторного) электрода и хлоридсеребряного электрода (электрод сравнения), погруженных в исследуемый раствор; рН исследуемого раствора фиксируется с помощью иономера, шкала которого градуирована в единицах рН.
1.Включите иономер в сеть, промойте электроды многократно и тщательно дистиллированной водой, осторожно осушая каждый раз мембрану электродов фильтрованной бумагой.
2.В стакан поместите 50 мл 0,1 Н раствора соли кобальта и определите
его рН.
3.Соберите установку для потенциометрического титрования: электрометрическую ячейку поместите на магнитную мешалку, опустите в раствор «магнитик» и над отверстием в держателе электродов установите бюретку, заполненную до нулевой отметки раствором щелочи (NaOH или KOH) известной концентрации (1Н и более). Включите мешалку.
4.Проведите титрование раствора. Чтобы получить более точные результаты, в начальный и конечный момент титрования добавляйте щелочь малыми порциями. Начинайте с одной капли, увеличивая объем щелочи до 0,1; 0,2; 0,3; 0,5мл. Затем – по 0,5мл и после резкого скачка рН – вновь добавляйте раствор щелочи по 0,1 мл. После каждого добавления новой порции раствора щелочи измеряйте рН исследуемого раствора. Результаты измерений занесите в таблицу:
V щелочи, мл
рН
5.На основании полученных данных постройте кривую титрования раствора соли кобальта раствором щелочи известной концентрации в координатах рН р-ра – V р-ра щелочи, мл.
6.Анализ кривой титрования.
Примерный ход кривой титрования представлен на рис:

На участке «а» по мере добавления щелочи рН раствора возрастает до начала появления осадка гидроксида металла. Горизонтальная площадка кривой (участок «б») соответствует рН образования гидроксида (когда рН образования гироксида достигнут и выпадение осадка продолжается, добавление щелочи практически не изменяет величину рН раствора).
Увеличение рН на |
участке «в» связано с накоплением в растворе |
(избыточной) свободной щелочи. |
|
7. Расчет |
. |
По найденной по графику величине рН образования гидроксида и соответствующей ему величине концентрации ионов водорода (


 ), рассичайте концентрацию ионов ОН- (
), рассичайте концентрацию ионов ОН- (



 ) в растворе над осадком по формулам:
) в растворе над осадком по формулам:







 ,
,
,
Зная исходную концентрацию раствора соли кобальта (0,05 моль/л), а так же концентрацию щелочи (Сщелочи, моль/л) и объем щелочи, пошедший на осаждение Со(ОН)2, равный (V2-V1), рассчитайте число моль Со2+, связанных в осадок (
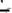






 ):
):
; |
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
