
4036
.pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Нижегородский государственный архитектурно-строительный университет»
Я.А. Васина, И.Л. Смельцова
ПРОЦЕССЫ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления подготовки 20.03.01
Техносферная безопасность, направленность (профиль) Безопасность технологических процессов и производств
Нижний Новгород, 2016
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Нижегородский государственный архитектурно-строительный университет»
Я.А. Васина, И.Л. Смельцова
ПРОЦЕССЫ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления подготовки 20.03.01
Техносферная безопасность, направленность (профиль) Безопасность технологических процессов и производств
Нижний Новгород, 2016
УДК 541(075)
Васина Я. А., Смельцова И.Л. Процессы в водных растворах электролитов. [Электронный ресурс]: учебно-метод. пос./ Я.А. Васина, И.Л. Смельцова; Нижегор. гос. архитектур.-строит. ун-т -Н.Новгород: Издание ННГАСУ, 2016. – 30 с, ил. 1. электрон. опт. диск (CD-R)
В методических указаниях приведены основные положения теории водных растворов электролитов, количественные характеристики протекающих процессов. Описаны методы экспериментального определения водородного показателя, растворимости труднорастворимых электролитов.
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления подготовки 20.03.01 Техносферная безопасность, направленность (профиль) Безопасность технологических процессов и производств
Составители доц. Я.А. Васина
доц. И.Л. Смельцова
Под редакцией проф. В.А. Яблокова
© Нижегородский государственный архитектурно-строительный университет, 2016.

ВВЕДЕНИЕ
В химически чистой воде протекает процесс самоионизации:
Н3О+ – ион гидроксония ; ОН- – ион гидроксила.
Схематично этот процесс изображают уравнением
Экспериментально установлено, что при температуре 25°С (298 К) произведение равновесных концентраций ионов Н+ и ОН- равны 10-14, т.е.
(1)
Это выражение называют ионным произведением воды и обозначают 




 или КW. В чистой воде
или КW. В чистой воде 








 и, следовательно, равны 10-7 моль/л.
и, следовательно, равны 10-7 моль/л.
Известно, что химически чистая вода чрезвычайно слабо проводит электрический ток.
При растворении в воде кислот, оснований, солей концентрации ионов Н+ и ОН- могут изменяться, но произведение концентраций остается постоянным. Ионы Н+ и ОН- присутствуют в водных растворах любого вещества. Однако, соотношение между их концентрациями может быть различным. В зависимости от этого растворы называют: нейтральными, кислыми и щелочными.
На практике для оценки характера среды в растворе удобно использовать вместо концентрации ионов Н+ водородный показатель (рН).
Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода в растворе:
(2)
По аналогии, рОН – гидроксильный показатель:
(3),
тогда после логарифмирования выражения (1) получим:
(4)
Следовательно, если:
, |
|
|
|
|
|
, |
рН < 7 – раствор кислый; |
|
|

, |
|
|
|
|
|
|
|
|
|
|
, рН > 7 – |
раствор щелочной; |
|
|
|||||||||||
|
|
|
|
|
|
, |
|
|
|
рН = 7 – |
раствор нейтральный. |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
На рис 1 изображена шкала рН.
|
рН |
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
0,1 М р-р NaOH |
|
|
|
|
|
||
|
|
|
13 |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Известковое |
|
|
|
|
12 |
|
|
|
|
|
|
|||
|
молоко |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
Речная вода |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
||
|
Кровь |
||||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
7 |
||
|
Молоко |
|
|
||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
Кофе |
|
|
|
6 |
||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
5 |
||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Желудочный |
|
|
|
|
3 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||
|
сок |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
0,1 М р-р НСl |
|
|
|
|
|
1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Возрастание
основности
Нейтральная среда
Возрастание
кислотности
Рис 1. Шкала рН. Значения рН для некоторых наиболее распространенных растворов.
Для измерения рН водных растворов применяются специальные приборы рН-метры или иономеры; для приблизительной оценки характера среды – индикаторы. Наиболее распространенные кислотно-основные

индикаторы: метилоранж, метилрот, лакмус, фенолфталеин и др., – изменяют свою окраску в определенном интервале рН.
По измеренной величине рН можно рассчитать 


 (моль/л):
(моль/л):
(5)
При растворении в воде кислот, оснований и солей их растворы приобретают способность проводить электрический ток. Это означает, что в растворе появляются подвижные электрически заряженные частицы – ионы. Вцелом раствор остается электронейтральным, следовательно, в нем присутствуют и положительные, и отрицательные ионы, суммарные заряды которых взаимно компенсируются.
Ионы перешедшие в раствор, удерживают вокруг себя «оболочку» из молекул воды, т.е. являются гидратированными. На рис. 2 схематически представлен процесс гидратации и последующего распада ионного кристалла (типа NaCl) и полярной молекулы (типа НCl) при данных условиях:
а) NaCl |
б) НСl |
Рис.2. Процессы гидратации и последующей диссоциации
а) ионного кристалла, б) полярной молекулы.
Распад на ионы связан либо с явлением диссоциации (разъединения ионов), либо с явлением ионизации (образованием ионов). Так, при растворении ионных соединений имеет место диссоциация. Роль растворителя в этом случае заключается в создании условий для разъединения ионов противоположного знака. Диссоциация ионных

соединений протекает тем легче, чем полярнее молекулы растворителя. При распаде ковалентных соединений на ионы происходит гетеролитический разрыв связи, т.е. ионизация.
В соответствии с современной теорией электролитов вещества делят на две группы: сильные и слабые электролиты.
Сильными электролитами называют вещества, кристаллы и молекулы которых под действием молекул воды практически нацело (необратимо) распадаются на ионы и не образуют в растворах ионных пар. К ним относятся все соли (исключение составляют, например, CdCl2, Hg2Cl2), щелочи, некоторые кислоты. Основная форма существования в растворе - ионная.
Слабые электролиты – это вещества, молекулы которых в водных растворах лишь частично распадаются на ионы. Процесс ионизации в этом случае обратим. В их растворах в равновесии находятся молекулы и ионы, а основная форма существования их в растворе – молекулярная.
Теорию электролитической диссоциации электролитов предложил Аррениус: 1) электролиты при растворении в воде распадаются на ионы без воздействия внешнего электрического поля. 2) в электрическом поле, за счет направленного движения ионов, электролиты проводят электрический ток. 3) диссоциация (распад) слабых электролитов подчиняется закону действия масс.
Такая запись означает, что в растворе происходят непрерывно два противоположных процесса: распад молекул на ионы (диссоциация) и соединение разноименно заряженных ионов в молекулы (ассоциация). Начиная с некоторого момента времени в системе устанавливается состояние, при котором противоположные процессы протекают с одинаковыми скоростями. Такое состояние называется равновесием.
Равновесие диссоциации слабого электролита можно охарактеризовать величиной, называемой константой электролитической диссоциации. Константа диссоциации – отношение произведения равновесных молярных концентраций ионов к равновесной молярной концентрации нераспавшихся молекул.
, (6)
где |
|
|
и |
|
|
|
|
– равновесные концентрации ионов, моль/л; |
|
|
|
||||||
|
|
|
|
|||||
|
|







 – равновесная концентрация молекул, нераспавшихся на ионы, моль/л.
– равновесная концентрация молекул, нераспавшихся на ионы, моль/л.

Величина константы диссоциации зависит от природы слабого электролита и растворителя, а также от температуры. Константа диссоциации является мерой относительной «силы» электролита. Чем больше эта величина, тем «сильнее» электролит. Сравнивая константы диссоциации двух электролитов уксусной кислоты 


















 и синильной кислоты
и синильной кислоты 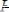















 можно сделать вывод, что уксусная кислота относительно более сильный электролит, чем синильная кислота.
можно сделать вывод, что уксусная кислота относительно более сильный электролит, чем синильная кислота.
Еще одной величиной, введенной для характеристики относительной силы электролита, является степень диссоциации (α). Степень электролитической диссоциации представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества:
(7) или
(7′),
где С0 – исходная концентрация электролита (до его распада на ионы), моль/л;
Сиона – равновесная концентрация иона, моль/л.
α может быть выражена в долях единицы или в процентах.
Для слабых электролитов, состоящих из одновалентных ионов Кt+ и An- и диссоциорующих по уравнению:
Константа равновесия связана с исходной концентрацией соотношением:
(8)














 , (8′)
, (8′)
Если α « 1, то:
, тогда |
|
|
|
|
|
(9) |
|
|
|
||||
|
|
|
|
Это выражение называется законом разбавления Оствальда, из которого следует, что с разбавлением раствора, т.е. с уменьшением концентрации, степень диссоциации слабого электролита увеличивается и,

наоборот, степень диссоциации слабого электролита уменьшается с увеличением его концентрации.
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ КИСЛОТ, ОСНОВАНИЙ И СОЛЕЙ
Рассмотрим кислоты, соли и основания с точки зрения электролитической диссоциации.
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода (Н+), например,
Кислоты, которые в растворе могут отщеплять более одного протона, называются многоосновными. Диссоциация таких слабых электролитов протекает в несколько стадий, т. е. ступенчато, например:
1 ступень
2 ступень
3 ступень
Иногда константу диссоциации кислоты обозначают Ка (acid), а рКа = –
lgКа.
Основания – это электролиты, при диссоциации которых в качестве анионов образуются ионы гидроксида (ОН-).
Основания, при диссоциации которых в раствор могут переходить два или несколько гидроксид-ионов, называются многокислотными, например:
1 ступень
2 ступень
Константу диссоциации основания обозначают Кв (base), а рКв =–lg Кв.

Соли – электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. Они диссоциируют практически нацело (необратимо), например:
ГИДРОЛИЗ СОЛЕЙ
При растворении некоторых солей в воде нарушается равенство концентраций Н+ и ОН- существующее в чистой воде. Это происходит, если ионы соли вступают в реакцию обменного взаимодействия с ионами воды (реакция гидролиза).
Как любая реакция ионного обмена, гидролиз солей протекает, если в результате взаимодействия образуется или слабый электролит (слабая кислота, слабое основание), или труднорастворимое соединение (основная соль, гидроксид).
Равновесие гидролиза, как любое химическое равновесие, можно охарактеризовать величиной константы равновесия. Эта величина называется константой гидролиза КГ.
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + Cl- + H2O ↔ NH4OH + H+ + Cl-
NH4+ + H2O ↔ NH4OH + H+
Кроме константы гидролиза КГ для расчетов используют величину степени гидролиза h.
Степень гидролиза - это отношение количества соли, подвергшейся гидролизу, к общему количеству растворенной соли.
(10)
Константа гидролиза КГ и степень гидролиза связаны между собой выражением, аналогичным закону разбавления Оствальда :
