
4030
.pdf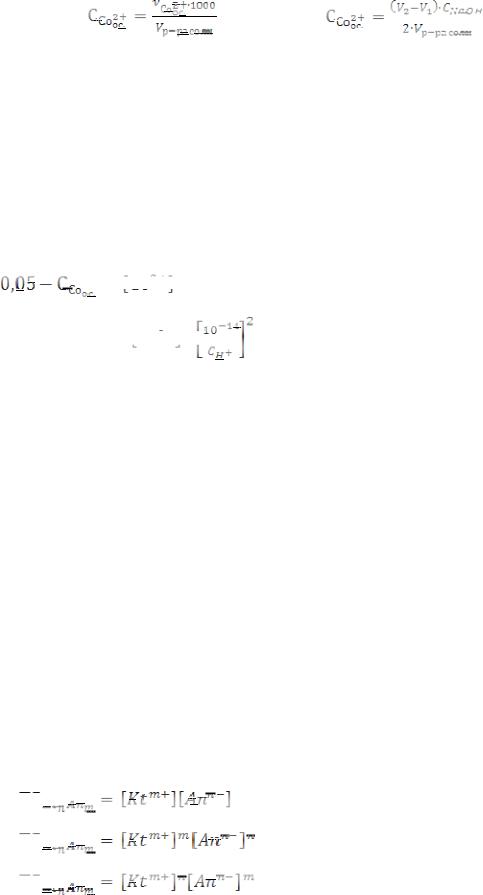
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Причем Vр-ра соли = 50 мл.
Равновесную молярную концентрацию ионов Со2+ (моль/л) определите как разность между исходной концентрацией Со2+ и концентрацией ионовСо2+, вступивших в реакцию:
Со2+ + 2 ОН- ↔ Со(ОН)2(тв)
Тогда равновесная концентрация ионов Со2+ равна:










 ;
;
Величина 














Сравните полученную величину ПР с табличными данными.
Сделайте выводы по проделанной работе.
ТЕСТ 2
Труднорастворимые электролиты.
1)Электролиты – это вещества . . .
2)Труднорастворимые электролиты – это . . .
3)Константа равновесия реакции растворения труднорастворимого электролита называется . . .
4)В насыщенном растворе труднорастворимого электролита произведение концентраций ионов есть величина . . . , называемая . . .
5)Для труднорастворимого электролита KtnAnm правило произведения растворимости представлено выражением:
1. 

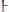


 2.
2. 

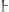



3. 

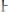



6) Величина ПР зависит от:

1.температуры, природы растворенного вещества, его концентрации;
2.температуры, природы растворенного вещества, природы растворителя;
3.температуры, природы растворенного вещества, природы растворителя, концентрации;
7)Растворимость вещества (Р) – это . . .
8)Величину молярной растворимости рассчитывают по величине произведения растворимости по формуле:
1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
; |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
9) В насыщенном растворе над осадком Мg(ОН)2 концентрация ионов
Мg2+:
1)Равна растворимости [Mg2+] = P(Мg(ОН)2);
2)Больше P(Мg(ОН)2 в 2 раза;
3)Меньше P(Мg(ОН)2 в 2 раза.
10) Если ПР (Мg(ОН)2) =6·10-10, то растворимость его P(Мg(ОН)2) равна:
1)5,3·10-4 моль/л;
2)1,73·10-5 моль/л;
3)5,5·10-4 моль/л;
11) Установите соответствие:
Раствор |
Соотношение |
||||||||||||||||||||||||||
1. |
Насыщенный |
А. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ненасыщенный |
Б. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
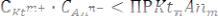
3. Пересыщенный |
В. |
|
|
|
|
|
|
|
|
|
|
|
||
|
||||||||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Условием выпадения осадка является: 1. А
2. Б
3. В
12) В насыщенном растворе Fe(ОН)2 концентрация ионов (ОН-) = =2Р(Fe(ОН)2) = 5,5·10-4 М. Концентрация ионов водорода в этом растворе равна:
1. 3,2·10-13; |
2. 1,7·10-11; |
3. 1,78·10-4; |
4. 2,8·10-4; |
рН насыщенного раствора Fe(ОН)2 равен: |
1. 3,56 |
||
|
|
|
2. 10,8 |
|
|
|
3. 12,5 |
13) рН насыщенного раствора Pb(ОН)2 равен 9. Концентрация ионов
ОН- в этом растворе равен: |
|
|
|
|
1. 5 моль/л; |
2. 10-5 моль/л; |
3. 10-9 моль/л; |
||
Растворимость Pb(ОН)2 равна: |
1. |
1,5·10-10 моль/л; |
||
|
|
2. |
0,5·10-5 моль/л; |
|
|
|
3. |
2, 0 моль/л. |
|
ВОПРОСЫ И ЗАДАЧИ.
1. К каким электролитам относится вода: кислотам, основаниям, амфолитам?
2. Докажите, что в чистой жидкой воде при Т = 298К 





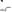








 моль/л, а рН = 7.
моль/л, а рН = 7.
3.Как изменится рН воды при повышении температуры, если
Нсамоионизации = 55,9 кДж/моль?
4.Какие вещества при растворении в воде нарушают равенство концентрации Н+ и ОН- и следовательно, изменяют 


 и рН среды?
и рН среды?
5. Для растворов сильных кислот |
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
Для растворов |
|||||||
|
|
|||||||||||||||||||||
сильных оснований |
|
|
|
|
|
|
|
|
|
|
|
. Докажите, что |
эти формулы |
|||||||||
|
|
|
|
|
|
|
||||||||||||||||
нельзя использовать для расчета рН в растворах соответственно слабых кислот и оснований.
6. рН раствора некоторого основания в воде связан с его концентрацией, как показано в таблице.
С, моль/л |
1 |
0,1 |
0,01 |
рН |
11,6 |
11,1 |
10,5 |
Докажите, какое это основание: сильное или слабое?
7.Вычислите рН 0,01М растворов HCl, CH3COOH, NH3·Н2O.
8.Докажите, что нельзя приготовить водный раствор С = 0. Можно ли приготовить раствор с рН=0? Если «да», то растворением каких веществ в воде и какова должна быть их концентрация?
9.Вычислите массу кристаллического NaOH, необходимого для приготовления 1 л раствора с рН =13.
10.Можно ли приготовить раствор с рН = 20?
11.Рассчитайте рН в 10-10М растворе HCl и 10-4М растворе NaOH.
12.Рассчитайте рН в 0,001М растворах HCl, HNO3, HI, HCOOH. Какова концентрация ионов Н+ в растворах этих кислот?
13.Как изменяется концентрация ионов Н+ и рН 0,2М раствора CH3COOH, если его разбавить в 5 раз?
14.В водных растворах СО2 существуют равновесия:
СО2 + Н2О ↔ Н2СО3

Н2СО3 ↔ Н+ + НСО3- |
К1 = 4,3·10-7 |
НСО3- ↔ Н+ + СО32- |
К2 = 5,5·10-11 |
При давлении СО2 1 атмосфера и температуре 25°С вода, насыщенная СО2, имеет концентрацию Н2СО3 0,04 моль/л. Вычислите 


 и рН в этом растворе.
и рН в этом растворе.
15.Вычислите концентрацию ацетат-ионов и рН 1·10-4М раствора
CH3COOH.
16.Докажите, что в водных растворах HCl и FeCl3 рН<7. Ответ аргументируйте уравнениями реакций.
17.Раствор содержит Н+, NO2- и HNO2 в состоянии равновесия. Рассчитайте 


 и рН такого раствора, если начальная концентрация HNO2
и рН такого раствора, если начальная концентрация HNO2
0,02 моль/л. Как изменится рН раствора (увеличится или уменьшится), если в него добавлять: 1) HCl; 2) НСN; 3) NаCl; 4) Н2О.
18.При каких молярных концентрациях растворов HCl и CH3COOH они будут иметь одинаковое значение рН, равное 4? Ответ аргументируйте расчетами.
19.К каким электролитам (сильным или слабым) относятся следующие вещества: NаCl, Н3РО4, HClО4, Nа3РО4, NН4ClО4? Рассчитайте рН в 0,005М растворах NаCl, Н3РО4, HClО4.
20.Какие процессы протекают в водных растворах H2SO4, Nа2SO4, CH3COOH, (NН4)2SO4? Вычислите рН в 0,001 М растворах H2SO4, Nа2SO4, CH3COOH.
21.Какие процессы протекают в водных растворах КОН, К2СО3, (NН4)2СO3, Н2СО3? Рассчитайте концентрацию КОН в растворе(моль/л), если рН его 13.
22.Рассчитайте концентрацию ОН- и рН в насыщенном растворе
Са(ОН)2.
23.Сравните значения рН в насыщенных растворах труднорастворимых гидроксидов: Mg(OH)2, Fe(OH)2, Al(OH)3.
24.В насыщенном растворе над осадком какого гидроксида: Mg(OH)2, Са(OH)2, Cd(OH)2 рН будет выше?
25.При каком значении рН закончится осаждение Fe(OH)3?
26.Рассчитайте рН, при котором концентрация ионов Mg2+ в растворе над осадком Mg(OH)2 равна 2·10-3моль/л.
27.рН раствора HNO3 равен 0,4. Рассчитайте молярную концентрацию HNO3 в этом растворе.
28.Имеются растворы с рН равным 5; 2; 4; 7; 6; 10. Рассчитайте концентрацию ОН- в этих растворах.
29.При какой концентрации уксусной кислоты она диссоциирована на 50%? Какова величина рН такого раствора?
30.Произведение растворимости NiC2O4 и Na3[AlF6] одинаковы (4·10-10). Каково соотношение между растворимостями (моль/л) этих солей?
31.Образуется ли осадок сульфата серебра, если к 0,02М раствору нитрата серебра добавить равный объем раствора сульфата натрия?
32.Исходя из произведения растворимости карбоната кальция, найдите массу СаСО3, содержащуюся в 100мл его насыщенного раствора.
33.Растворимость гидроксида магния при 180С равна 1,7·10-4М. Рассчитайте произведение растворимости гидроксида магния при этой температуре.
34.К 50 мл 0,001Н раствора соляной кислоты добавили 450 мл 0,0001Н раствора нитрата серебра. Выпадет ли осадок хлорида серебра?
35.Найдите массу ионов серебра в 1 литре насыщенного раствора бромистого серебра.
36.В насыщенном растворе на осадком какого гидроксида: кальция, магния, кадмия рН будет выше?
37.В каком объеме насыщенного раствора сульфида серебра содержится 1 мг растворенной соли?
38.Вычислить объем воды, необходимый, для растворения при 250С 1г сульфата бария.
39.В 500 мл воды при 180С растворяется 0,0166г хромата серебра. Чему равно произведение растворимости этой соли?
40.Растворимость карбоната кальция при 250С равна 6,9·10-5 моль/л. Вычислить ПР этой соли.
41.Смешаны равные объёмы 0,02Н растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция?
42.ПР оксалата кальция равно 2·10-9. Найдите растворимость этой соли
в0,1М растворе оксалата аммония.
43.Для растворения 1,16г иодида свинца потребовалось 2 литра воды. Рассчитайте произведение растворимости соли.
44.Насыщенный раствор сульфата кальция смешивают с равным объёмом оксалата аммония, содержащим 0,0248г этой соли в 1л воды. Растворимость сульфата кальция 1г/л. Выпадет ли осадок оксалата кальция?
45.ПР(Pb3(PO4)2 = 7,9 · 10-43 (250С). Определите растворимость соли в г/л и концентрацию каждого из ионов в насыщенном растворе при этой температуре.
46.Растворимость сульфата кальция 1г/л. Во сколько раз она изменится (уменьшится или увеличится) при добавлении к 1л этого раствора 0,1г сульфата натрия?
47.Произведение растворимости CaF2 при 180С равно 3,4·10-11. Вычислить равновесные концентрации иона кальция и фторид-иона в насыщенном растворе при этой температуре.
48.Сколько литров воды потребуется для растворения 1г оксалата кальция при 180С? ПР(CaC2O4) = 3,8·10-9.
49. Вычислить равновесную концентрацию ионов серебра в насыщенном водном растворе хлорида серебра. Во сколько раз она
изменится при добавлении к 1л такого раствора 0,1 моль хлорида натрия.
ПР(AgCl) = 1,2·10-10.
50. Определить ПР хромата серебра, если растворимость хромата серебра равна 1,076·10-4 моль/л.
Приложение
Константы диссоциации кислот и оснований
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
Электролит |
|
|
К |
рК |
|
|
|
|
|
|
|
|
|
|
Кислоты |
|
|
|
|
|
|
|
Азотистая кислота |
HNO2 |
|
5,1·10-4 |
3,29 |
|
|
|
|
|
|
|
Муравьиная кислота |
НСООН |
|
1,8·10-4 |
3,75 |
|
|
|
|
|
|
|
Сернистая кислота |
K1 |
|
1,4·10-2 |
1,94 |
|
Н2SО3, |
|
|
|
|
|
|
К2 |
6,2·10-8 |
7,2 |
||
|
|
|
|
|
|
Сероводород Н2S |
K1 |
|
1·10-7 |
6,99 |
|
|
|
|
|
|
|
|
|
К2 |
2,5·10-13 |
12,6 |
|
|
|
|
|
|
|
Угольная кислота |
K1 |
|
4,5·10-7 |
6,35 |
|
Н2СО3 |
|
К2 |
|
4,7·10-11 |
10,32 |
Уксусная кислота СН3СООН |
|
1,74·10-5 |
4,76 |
||
|
|
|
|
|
|
Фосфорная кислота |
K1 |
|
7,1·10-3 |
2,15 |
|
|
(орто) |
|
|
|
|
Н3РО4 |
К2 |
6,3·10-8 |
7,21 |
||
|
|
|
|
|
|
|
|
К3 |
5·10-13 |
13,3 |
|
|
|
|
|
||
Циановодород HCN |
|
5·10-10 |
9,3 |
||
|
|
|
|
|
|
Щавелевая кислота |
K1 |
|
5,6·10-2 |
1,25 |
|
Н2С2О4 |
|
К2 |
|
5,4·10-5 |
4,27 |
Фтороводород HF |
|
|
6,2·10-4 |
3,21 |
|
|
|
|
|
|
|
|
|
|
Основания |
|
|
|
|
|
|
|
|
Водный раствор аммиака |
NH4OH |
|
1,76·10-5 |
4,76 |
|
|
|
|
|
||
Кальция гидроксид Са(OH)2 |
|
|
|
||
|
|
|
|
|
|
|
|
К2 |
|
5,9·10-2 |
1,4 |
|
|
|
|
|
|
Литература
1.Глинка Н.Л. Задачи и упражнения по общей химии: Уч. пособие для вузов / Под ред. В.А. Рабинович и Х.М. Рубиной. – М.: Интеграл-Пресс, 2002.
–240 с.
2.Харитонов Ю. Я. Аналитическая химия (аналитика). В 2 т. Т. 2. Физико-химические (инструментальные) методы анализа. Учеб. для вузов / Ю. Я. Харитонов – М.: Высш. шк., 2001.-615с. : ил.
3.Основы аналитической химии. В 2 т. Т. 2. Методы химического анализа: Учеб. для вуза / Ю.А. Золотов, Е.Н. Дорохова, В.И. Федеева и др. Под ред. Ю.А. Золотов – М.: Высш. шк., 2002.-351с. : ил.
4.Основы аналитической химии. Задачи и вопросы: Учеб. для вуза / В.И. Федеева, Ю.А. Барбалат, А.В. Гармаш и др.; Под ред. Ю.А. Золотов – М.: Высш. шк., 2002.-412 с. : ил
Васина Янина Александровна
Смельцова Ирина Леонидовна
ПРОЦЕССЫ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления подготовки 09.03.02 Информационные системы и технологии
Федеральное государственное бюджетное образовательное учреждение высшего образования «Нижегородский государственный архитектурно-строительный университет»
603950, Нижний Новгород, ул. Ильинская, 65.
http://www. nngasu.ru, srec@nngasu.ru
