
3137
.pdf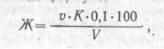
21
5.2. Определение карбонатной жесткости воды
Определение осуществляют титрованием пробы воды соляной кислотой в присутствии индикатора метилового оранжевого. Протекающую при этом реакцию можно выразить уравнением:
НСО3-+Н+ = С02+Н20.
Аппаратура , реактивы
Пипетки на 1, 2, 5, 10 мл. ‘ Колбы конические на 250 мл. Бюретка на 25 мл.
Раствор соляной кислоты, 0,1 н.
Метиловый оранжевый (индикатор), 0,1 %-ный водный раствор.
Выполнение работы
В коническую колбу вносят 100 мл исследуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой. Затем прибавляют 2—3 капли индикатора и титруют 0,1 н раствором соляной кислоты до перехода окраски индикатора из желтой в розовую. Карбонатную жесткость воды (Ж), мг-экв/л, рассчитывают по ФОРМУЛЕ:
где v— объем 0,1 н. раствора соляной кислоты, израсходованный на титрование, мл; К— поправочный коэффициент к нормальности раствора соляной кислоты;
V —- объем пробы, взятой для определения, мл.
Некарбонатную жесткость определяют как разницу между общей жесткостью и карбонатной.
5.3.Определение содержания ионов кальция и магния в воде
Содержание ионов кальция в воде определяют комплексонометрическим методом, основанным на титровании воды трилоном Б. В качестве индикатора применяют мурексид (аммониевая соль пурпурной кислоты), который образует с ионами кальция при pH 10 соединение малинового цвета. В точке эквивалентности, когда все ионы кальция связываются трилоном Б, соединение кальция с мурексидом разрушается и появляется окраска чистого индикатора, имеющего в щелочной среде фиолетовый цвет.
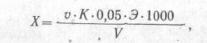
22
Аппаратура , реактивы
Пипетки на 1, 2, 5, 10 мл. Колбы конические на 250 мл. Бюретка на 25 мл.
Раствор едкого натра, 2 н.
Мурексид (индикатор), 1:100. Растирают в ступке 1 г мурексида с 100 г хлористого натрия х. ч.
Трилон Б (комплексен (III), 0,05 н раствор.
Выполнение работы
В коническую колбу отмеривают 100 мл исследуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой, добавляют 2 мл 2 н раствора едкого натра и несколько кристалликов индикатора мурексида. Раствор при этом приобретает интенсивно розовую окраску. Титруют раствором трилона Б до перехода окраски в фиолетовый цвет, устойчивый в течение 3 мин. Для того чтобы лучше уловить изменение окраски, титруют в присутствии «свидетеля», в качестве которого можно использовать перетитрованную пробу.
Содержание ионов кальция Х (мг/л) вычисляют по формуле:
где v – объем раствора трилона Б, израсходованный на титрование, мл; К – поправочный коэффициент к нормальному раствору
трилона Б; Э — эквивалент кальция, равный 20,04;
V объем исследуемой воды, взятой для определения, мл.
Содержание ионов магния в воде определяют по разности между общей жесткостью и содержанием ионов кальция.
Выводы : в исследуемой пробе воды определены: общая жесткость .____. мг-экв/л; карбонатная жесткость .____. мг-экв/л; содержание ионов Са2+ .____. мг/л; содержание ионов .____. мг/л.
ВОПРОСЫ
1.Какие вещества обусловливают жесткость воды?
2.Какое значение имеют соли жесткости для оценки качества воды?
3.Какими методами определяют карбонатную и общую жесткость воды?
4.В чем заключается сущность комплексонометрического метода определения общей жесткости воды?
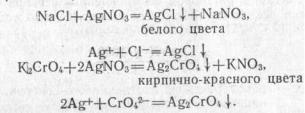
23
ЛАБОРАТОРНАЯ РАБОТА № 6
ОПРЕДЕЛЕНИЕ ХЛОРИДОВ И СУЛЬФАТОВ В ВОДЕ
Ц е л ь р а б о т ы : Весовым и объемным методом определить содержание в воде хлоридов и сульфатов.
Хлориды и сульфаты благодаря своей большой растворимости присутствуют во всех природных водах обычно в виде натриевых, кальциевых и магниевых солей. Хлориды и сульфаты, присутствующие в воде в значительных концентрациях, являются причиной ее агресивности по отношению к бетону. Так, воды, содержащие сульфат-ионы свыше 250 мг/л, оказывают разрушающее действие на бетонные сооружения вследствие образования гипса (в результате реакции между сульфатами и известью цемента), что вызывает увеличение объема и образование трещин в бетоне. Присутствие в воде значительных количеств хлоридов приводит к выщелачиванию и разрушению бетонного камня вследствие образования с известью растворимых хлористого магния и кальция.
Повышенные концентрации хлоридов и сульфатов в воде приводят к увеличению общего солесодержания воды, что служит препятствием для использования такой воды для питания паровых котлов, в производстве ряда полимеров, синтетического каучука, некоторых сортов бумаги и др.
Присутствие в питьевой воде повышенных количеств сульфата натрия нарушает деятельность желудочно-кишечного тракта, в то время как сульфаты и хлориды магния и кальция обусловливают некарбонатную жесткость воды. Согласно СанПиН 2.1.4.1074-01 допустимые концентрации хлоридов и сульфатов в воде хозяйственно-питьевого назначения составляют до 350 мг/л и до 500 мг/л, соответственно.
6.1. Определение содержания хлоридов в воде
Метод основан на титровании хлорид-ионов в нейтральной среде или слабо щелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, в результате чего желтая окраска раствора переходит в оранжево-желтую.
При титровании протекают реакции:
Так как растворимость AgCl меньше, чем растворимость AgCl2СГ04, ТО В

24
осадок в первую очередь выпадет хлорид серебра, а затем — хромат серебра.
Аппаратура , реактивы
Пипетки на 10, 50, 100 мл. Колбы конические на 250 мл.
Раствор хлористого натрия. 0,8245 г х. ч. NaCl растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 л. 1 мл раствора содержит 0,5 мг С1~.
Раствор хромовокислого калия, 5 %•
Раствор азотнокислого серебра. 2,4 х. ч. AgN03 растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1 л.
1 мл раствора эквивалентен 0,5 мг ионов С1~.
Поправочный коэффициент к титру раствора азотнокислого серебра устанавливают по следующей методике: в коническую колбу вносят 10 мл раствора хлористого натрия и 90 мл дистиллированной воды, добавляют 1 мл раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода лимонно-желтой окрастки мутного раствора в оранжево-желтую, не исчезающую в течение 15—20 с. Поправочный коэффициент (К) вычисляют по формуле:
где v — объем азотнокислого серебра, израсходованный па титрование, мл.
В ы п о л н е н и е р а б о т ы
Вконическую колбу отмеривают 100 мл исследуемой воды или меньший
ееобъем (10—15 мл), доведенный до 100 мл дистиллированной водой, добавляют 1 мл раствора хромовокислого калия и титруют раствором азотнокислого серебра до перехода окраски осадка из белой в оранжево-желтую. Содержание хлор-иона (А), мг/л, вычисляют по формуле:
где v — объем раствора азотнокислого серебра, израсходованный на титрование, мл:
К — поправочный коэффициент к титру раствора нитрата серебра; g — количество хлорид-ионов, соответствующее 1 мл 'раствора
азотнокислого серебра, мг;
V— объем воды, взятой для титрования, мл.
Методика определение сульфатов изучается в курсе дисциплины «Химия воды и микробиология».
25
ЛАБОРАТОРНАЯ РАБОТА № 7
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ЖЕЛЕЗА В ВОДЕ
Цель работы: колориметрическим методом определить концентрацию железа (общего, закисного и окисного) в воде.
Железо появляется в природных водах в результате перехода его из различных горных пород под действием окислителей (кислород) или под действием кислот (угольной, органических), а также вымывается из почв (растворимые гуматы железа).
В природных водах железо представлено неорганическими и органическими соединениями, находящимися как в истинно-растворенном, коллоидном, так и во взвешенном состояниях.
Преобладающей формой железа в подземных водах является растворимый бикарбонат закисного железа, который устойчив в присутствии больших количеств углекислоты и в отсутствии растворенного кислорода. В поверхностных водах, pH которых больше 7, железо находится в виде коллоидов (Fе(ОН)з), частично соединений Fe2+, тонкодисперсной взвеси (FeS), а также входит в состав растворимых органических комплексов (гуматов).
Качество воды зависит от концентрации железа в ней. Так, повышенные концентрации железа ухудшают органолептические свойства воды — в воде появляется железистый привкус, дополнительная цветность. При транспортировке такой воды по трубопроводам в результате жизнедеятельности железобактерий на внутренней поверхности труб проявляются биообрастания, вызывающие снижение сечения труб, а иногда их полную закупорку. При повышенной концентрации железа в воде наблюдаются коррозионные процессы, следствием которых является образование отложений.
Поэтому концентрация железа в питьевой и некоторых промышленных водах регламентируется. Согласно СанПиН 2.1.4.1074-01 в питьевой воде содержание железа допускается до 0,3 мг/л, а предприятия по производству целлюлозы, пластмасс, текстильные предприятия потребляют воду с содержанием железа от 0,1 до 0,03 мг/л.
Метод определения концентрации окисного железа Fe3+ основан на его взаимодействии в сильнокислой среде с роданидом с образованием окрашенного в красный цвет комплексного соединения роданового железа:
Fe3++6CNS- = [Fe(CNS)6]3-
Чувствительность метода 0,02 мг/л Fe3+. Определение Fe общего (сумма ионов Fe3+ и Fe2+) производят после предварительного окисления соединений закисного железа персульфатом аммония, используя метод, рассмотренный выше. Чувствительность метода 0,05 мг/л. По разности между содержанием общего железа и содержанием окисного железа, находят содержание закисного
26
железа.
О т б о р п р о б
Объем пробы воды для определения — не менее 200 мл. Анализ следует проводить в момент отбора проб.
А п п а р а т у р а , р е а к т и в ы
Фотоэлектроколориметр, ФЭК-56 М. Пипетки на 5, 10, 25, 50 мл.
Колбы мерные на 50, 100, 1000 мл. Колориметрические цилиндры на 100 мл.
Основной стандартный раствор железоаммонийных квасцов 0,8836 г свежеперекристаллизованных железоаммонийных квасцов растворяют в мерной колбе на 1 л в небольшом количестве дистиллированной воды, добавляют 2 мл концентрированной соляной кислоты и доводят до метки дистиллированной водой. 1 мл раствора содержит 0,1 мг железа.
Рабочий стандартный раствор железоаммонийных квасцов Готовят рабочий раствор в день проведения анализа разбавлением
основного раствора в 10 раз дистиллированной водой. 1 мл раствора содержит 0,01 мг железа.
Раствор роданистого аммония, или калия, 50%-ный. 50 г роданида растворяют в 50 мл дистиллированной воды.
Раствор соляной кислоты, плотностью 1,12 г/см3 К 65 мл дистиллированной воды приливают 100 мл соляной кислоты
плотностью 1,19 г/см3.
Аммоний надсернокислый (персульфат), кристаллический, х. ч.
7.1. Визуальный метод определения железа (метод уравнивания)
7.1.1. Определение содержания общего железа
В колориметрический цилиндр помещают 50 мл тщательно перемешанной исследуемой воды, добавляют 1 мл соляной кислоты (плотностью 1,12 г/см3) и несколько кристалликов персульфата аммония. Цилиндр ставят на водяную баню и кипятят 3—5 мин. К охлажденному раствору добавляют 2 мл 50 %- ного раствора роданида, перемешивают. Одновременно готовят эталонный раствор. Для этого в колориметрический цилиндр помещают 0,5 мл рабочего стандартного раствора железоаммонийных квасцов (1 мл содержит 0,01 мг Fe3+) и доводят раствор до 50 мл дистиллированной водой. Добавляют 1 мл НС1 (Д= 1,12 г/см3), несколько кристалликов персульфата аммония, кипятят на водяной бане 3—5 мин. После охлаждения приливают 2 мл 50 %-ного раствора роданида. Полученные окраски растворов в обеих колориметрических цилиндрах, уравнивают на белом фоне. Для этого отливают более окрашенный раствор до того момента, когда окраски растворов в обоих цилиндрах не сравниваются.

27
Отмечают объем растворов, оставшихся в цилиндрах после колориметрирования, мл.
Содержание общего железа X (в мг/л) вычисляют по формуле:
где а— количество рабочего стандартного раствора железоаммонийных квасцов, мл;
01 — количество железа в рабочем растворе железоаммонийных квасцов, мг/мл;
20— коэффициент пересчета с 50 мл объема пробы на 1 л;
W1 — объем эталонного раствора, мл; после колориметрирования; W2— объем исследуемого раствора после колориметрирования, мл.
7.1.2. Определение содержания окисного железа
Определение окисного железа производят аналогично определению общего железа, но при этом опускают операции, связанные с окислением соединений железа: добавлением персульфата аммония и выдерживанием на водяной бане.
Содержание окисного железа Л) (мг/л) рассчитывают по формуле:
где обозначения см. выше
Содержание закисного железа Х2 (мг/л) рассчитывают по разности между концентрацией общего железа в воде и концентрацией окисного железа:
7.2.Фотоколориметрический метод определения железа в воде
7.2.1.Определение содержания общего железа
Вмерную колбу на 50 мл отбирают 50 мл тщательно перемешанной исследуемой воды или меньший объем (в зависимости от содержания железа в
воде) и доводят объем до метки дистиллированной водой. Затем добавляют 1 мл соляной кислоты (плотностью 1,12 г/см3), несколько кристалликов персульфата аммония, перемешивают и добавляют 1 мл 50%-ного роданида. После перемешивания сразу же измеряют оптическую плотность окрашенного
раствора на ФЭК-56 М при длине волны 490— 500 нм (сине-зеленый светофильтр) в кюветах с толщиной слоя 3 см по отношению к холостой пробе. В качестве холостой пробы используют дистиллированную воду со всеми

28
добавленными реактивами.
Концентрацию общего железа находят по градуировочному графику. Для построения градуировочного графика в мерные колбы на 50 мл
помещают 0,0; 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 мл рабочего стандартного раствора железоаммонийных квасцов и доводят объем дистиллированной водой до метки. Получают серию стандартных растворов с содержанием железа 0,0; 0,1; 0,2; 0,4; 0,6; 0,8; 1,0 мг/л.
К полученным растворам добавляют 1 мл НС1 (d = 1,12 г/см3), несколько кристалликов персульфата аммония, после перемешивания приливают 2 мл 50%-ного раствора роданида. Затем определяют оптические плотности окрашенных растворов на ФЭК-56 М при X =490—500 нм в кюветах с 1—3 см против контроля (дистиллированная вода со всеми реактивами).
Градуировочный график строят в координатах:
оптическая плотность окрашенных растворов — концентрация железа в стандартных растворах.
Концентрацию общего железа Х (в мг/л) вычисляют по формуле:
Где С — концентрация железа, найденная по градуировочному графику, мг/л; V — объем пробы, взятой для определения, мл.
7.2.2.Определение содержания окисного железа
Вмерную колбу помещают 50 мл тщательно перемешанной пробы или
меньший объем, доведенный до 50 мл дистиллированной водой. Добавляют 1 мл раствора HCI (d= 1,12 г/см3) и 2 мл 50%-ного раствора роданида, перемешивают. Измеряют оптическую плотность окрашенного раствора на ФЭК-56 М. Условия фотометрирования аналогичны приведенным в п. 2.1.
Концентрацию окисного железа находят по градуировочному графику. Для построения градуировочного графика в мерные колбы на 50 мл вносят
0,0; 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 мл рабочего стандартного раствора железоаммонийных квасцов и доводят объемы до метки дистиллированной водой. К полученным растворам добавляют 1 мл раствора HCI (d— 1,12 г/см3) и 2 мл 50%-ного раствора роданида, перемешивают. Измеряют оптические плотности окрашенных растворов на ФЭК-56 М при Х = =490—500 нм в кюветах с 1=3 см против контроля (дистиллированная вода со всеми реактивами). Градуировочный график строят в координатах: оптические плотности окрашенных растворов — концентрация железа в стандартных растворах.
Концентрацию окисного железа Х1 (в мг/л) вычисляют по формуле:
29
где С— концентрация окисного железа по градуировочному графику, мг/л; V — объем пробы, взятый для определения мл.
Выводы:
Установлено:
содержание общего железа в воде составляет_________мг/л; окисного железа __________мг/л; закисного железа _________мг/л
Во п р о с ы
1.В каких формах присутствует железо в природных водах?
2.Оценка качества воды в зависимости от концентрации железа в ней.
3.Сущность колориметрических методов определения железа в воде.
9
Литература
1.Водный кодекс Российской Федерации от 03.06.2006 №74-ФЗ (ред. от
28.11.2015) (с изм. и доп., вступ. в силу с 01.01.2016).
2.СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения (переиздан с учетом изм. Пост. № 10 от 25.02.10)).
3.СанПин 2.1.5.980-00. Гигиенические требования к охране поверхностных вод (введен с 01.01.2001 г.).
4.Лабораторный практикум по анализу вод – Н. Новгород: ННГАСУ,
2005.
