
2502
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
«Нижегородский государственный архитектурно-строительный универ-
ситет»
С.В.Митрофанова, И.Л.Смельцова
ХИМИЧЕСКИЕ ЕДИНИЦЫ КОЛИЧЕСТВА ВЕЩЕСТВА
Учебно-методическое пособие
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления 05.03.06 Экология и Природопользование,
направленность (профиль) Природопользование
Нижний Новгород
2016
2
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего
образования
«Нижегородский государственный архитектурно-строительный университет»
С.В.Митрофанова, И.Л.Смельцова
ХИМИЧЕСКИЕ ЕДИНИЦЫ
КОЛИЧЕСТВА ВЕЩЕСТВА
Учебно-методическое пособие
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления 05.03.06 Экология и Природопользование,
направленность (профиль) Природопользование
Нижний Новгород
ННГАСУ
2016
3
УДК 546 (075.8)
Митрофанова С.В., Смельцова И.Л. Химические единицы количества вещества
[Электронный ресурс]: учеб. - метод. пос. / С.В.Митрофанова, И.Л. Смельцова;
Нижегор. гос. архитектур. - строит. ун - т – Н. Новгород: ННГАСУ, 2016. – 16
с; ил. 1 электрон. опт. диск (CD-RW)
Рассмотрены единицы количества веществ, используемых в химии - угле-
родная единица, моль и эквивалент, а также производные от них - молярная и эк-
вивалентная масса. Предложены лабораторные работы по экспериментальным ме-
тодам определения молярной массы веществ, и эквивалентной массы металлов и солей.
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления 05.03.06 Экология и Природопользование, направленность (профиль) Природопользование
© С.В.Митрофанова,
И.Л. Смельцова, 2016
© ННГАСУ, 2016.
4
Введение Материальная система обладает бесконечным множеством различных
свойств, которые описываются количественными и качественными параметрами.
Некоторые из этих свойств прямо пропорциональны количеству вещества. К ним относятся: масса - мера гравитации и инерции; объем и число структурных эле-
ментов, составляющих вещество (молекулы, атомы, электроны и другие частицы).
Эти свойства называют экстенсивными. Остальные свойства - интенсивные. Они не зависят от количества вещества. Например, плотность, давление, температура и другие.
Количества вещества системы выражают через величины экстенсивных свойств. В практике в качестве единицы количества вещества используют величи-
ны массы и объема. В химии и атомной физике единицами количества вещества служат углеродная единица, моль и эквивалент.
Углеродная единица равна 1/12 части массы атома изотопа углерода 12С. В
соответствии с этим массу атомов и молекул, выраженную в углеродных единицах называют относительной атомной и молекулярной массой (так масса атома водо-
рода равна 1,00797 углеродной единицы, масса атома кислорода - 15,9994 угле-
родной единицы).
Единица количества вещества «моль» связана с числом структурных эле-
ментов. Моль - это такое количество вещества, в котором содержится столько структурных элементов (например, молекул, атомов) сколько атомов содержится в
12 г изотопа углерода 12С. В 12 г этого изотопа содержится 6,02 1023 атомов (число Авогадро).
1023 атомов (число Авогадро).
Единица количества вещества «эквивалент» является функцией числа струк-
турных элементов и валентности атомов, образующих это вещество. Определение эквивалента вытекает из закона эквивалентов: количества вещества, выраженные в эквивалентах, для всех участников данной химической реакции одинаково.
Например, для реакции А + В = С + D 5 эквивалентов вещества А взаимодей-
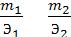
5
ствует с 5 эквивалентами вещества В и при этом образуется по 5 эквивалентов ве-
ществ С и D. |
|
В общем случае: |
= , |
где: m - масса вещества, вступившего в реакцию,
Э - эквивалентная масса вещества.
Эквивалент - это такое количество вещества, которое взаимодействует с 1
эквивалентом водорода. Эквивалент водорода это такое его количество, в котором содержится 6,02.1023 атомов.
Масса и количества вещества, выраженное в молях и эквивалентах, связаны
между собой уравнениями: |
|
m = M . |
(1) |
m = Э . n , |
(2) |
где: m - масса вещества; |
|
- количество вещества в молях;
n - количество вещества в эквивалентах;
М - молярная масса вещества;
Э - эквивалентная масса вещества.
Молярная масса М выражается в единицах г/моль, а эквивалентная Э в г/экв.
Нетрудно найти связь между эквивалентной и молярной массой вещества из формул (1) и (2):
Э = М . / n |
(3) |
Отношение / n обратно пропорционально произведению числа атомов или ионов на их валентность. Найдем эквивалентную массу кислорода: молярная масса кислорода равна 32 г/моль, молекула кислорода состоит из двух атомов, ва-
лентность кислорода равна 2, тогда, Э = М . 1/ 2.2 = 32 . 1/ 4 = 8 г/экв.
Таким образом, эквивалентную массу простого вещества можно рассчитать по формуле:

6 |
|
М вещества |
|
Э простого вещества = |
(4) |
Число атомов . Валентность элемента |
|
Очевидно, что эквивалентная масса веществ, образованных атомами, прояв-
ляющими постоянную валентность, постоянна. Например, ЭН= 1 г/экв, ЭО= 8 г/экв, ЭАl= 9 г/экв.
Понятия эквивалента и эквивалентной массы распространяется и на слож-
ные вещества. Эквивалентная масса сложного вещества равна сумме эквивалент-
ных масс простых веществ или ионов, образующих это вещество. Например,
ЭAl2O3 = ЭAl + ЭО = 9 г/экв + 8 г/экв = 17 г/экв;
ЭН2SO4 = ЭН+ + ЭSO42- |
= 1 г/экв + 48 г/экв = 49 г/экв. |
Эквивалентные массы сложных веществ можно рассчитать по следующим |
|
формулам: |
|
Мкислоты |
|
Экислоты = |
(5) |
Число атомов водорода в формуле
Моснования
Эоснования = |
(6) |
Число групп (ОН-) в формуле
Мсоли
Эсоли = |
(7) |
Число атомов металла . Валентность металла
Моксида
Эоксида = |
(8) |
Число атомов элемента . Валентность элемента

7
Например, молярная масса серной кислоты 98 г/моль, число атомов водорода равно 2, поэтому 
Лабораторная работа №1. Определение молярной массы газов.
Цель работы: определить молярную массу одного из газов - воздуха или диоксида углерода (углекислого газа).
Молярную массу газов вычисляют с помощью уравнения Менделеева-
Клапейрона:
 ,
,
где: Р - давление газа (Па, атм или мм рт.ст.);
V - объем газа (м3, л или мл);
- количество вещества в молях;
Т- температура (К);
R - универсальная газовая постоянная
Для расчетов выбираете наиболее удобные единицы. Отсюда:
(9)
Экспериментальная часть.
|
|
1. Из сосуда, изображенного на рисунке |
|
|
1, откачивают воздух. Для этого сосуд, изоб- |
|
|
раженный на рисунке 1, соединяют резиновым |
1 |
2 |
шлангом с вакуумным насосом. При открытом |
Рис. 1. Сосуд для определения молярной массы газа.
8
кране 1 и закрытом кране 2 включить насос на 2-3 минуты. Закрыть кран 1, отсо-
единить сосуд от насоса.
2.Вакуумированный сосуд осторожно взвешивают на технических весах с точностью 0,01 г. Записать массу сосуда m1.
3.Для заполнения сосуда воздухом осторожно открыть краны 1 и 2. Для за-
полнения сосуда углекислым газом, его с помощью резинового шланга присоеди-
няют к аппарату Киппа, осторожно открывают краны 1 и 2, открывают кран на ап-
парате Киппа и медленно пропускают СО2. При этом заполняемый сосуд распола-
гают вертикально и СО2 подают снизу.
4.Взвешивают сосуд, заполненный газом на технических весах. Записать массу сосуда m2 и по разности m2 - m1 найти массу газа.
5.Определяют значения комнатной температуры и атмосферного давления.
Используя полученные данные:
m1 - масса вакуумированного сосуда; m2 - масса сосуда, заполненного газом;
Р - атмосферное давление (давление газа);
Т – температура.
Молярная масса воздуха равна 29 г/моль.
По уравнению (9) рассчитывают молярную массу газа.
Вычисляют относительную погрешность:
 ,
,
где: Мэкс. - молярная масса газа, вычисленная из экспериментальных дан-
ных;
Мрасч. - молярная масса газа, рассчитанная на основании относитель-
ных атомных масс.
|
ВЫВОД |
|
1. Получено экспериментальное значение молярной массы ............ |
(воздуха или |
|
СО2), равное |
....................г/моль. |
|

9 |
|
2. Относительная ошибка измерения составила ................................. |
%. |
Лабораторная работа №2.
Определение молярной массы металла.
Цель работы: экспериментальным путем определить молярную массу маг-
ния.
В основе одного из экспериментальных методов определения молярной мас-
сы металлов, вытесняющих из кислот водород, лежит реакция между навеской ме-
талла и избытком кислоты.
Mg + 2 HCl = MgCl2 + H2
При растворении двухвалентного металла число молей, выделившегося во-
дорода, равно числу молей растворившегося металла. Измерив объем выделивше-
гося водорода, его давление и температуру вычисляют число молей выделившего-
ся водорода из уравнения Менделеева-Клапейрона
(10)
ν (H2) = νМg, а из уравнения (1) ММg = mм/ νМg, тогда
Подставив mH2 из уравнения (11) в уравнение (10), получим:
(11)
Экспериментальная часть.
1. В короткое колено сосуда 1, изображенного на рисунке 2, помещают навеску магния, а в длинное колено избыток соляной кислоты (15 мл 13 % раство-

10
ра). Сосуд закрываем пробкой с резиновой трубкой, соединяющей сосуд 1 с изме-
рительной бюреткой 5.
2. Открывают кран 2 и с помощью урав-
нительной склянки с водой 3 заполняют бю-
ретку до метки 4, совместив уровни воды в из-
мерительной склянке и бюретке. Закрывают кран 2.
3. Осторожно приливают кислоту к маг-
нию небольшими порциями.
4. После окончания реакции сосуд 1
охлаждают до комнатной температуры и изме- Рис. 2. Схема установки. ряют объем выделившегося водорода, предварительно совместив уровни воды в уравни-
тельной склянке и бюретке.
5. Определяют температуру и атмосферное давление.
Из экспериментальных данных:
mм - масса магния (г),
VH2 - объем выделившегося водорода (л),
Р - атмосферное давление (атм),
Т - температура (К),
R - универсальная газовая постоянная
(для расчетов выбираете наиболее удобные единицы),
по уравнению (11) находят Мм.
Относительную погрешность измерения вычисляют по формуле:
 ,
,
