
1611
.pdf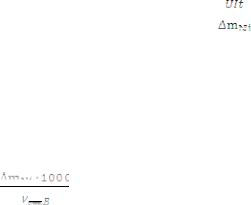
21
где ∆mNi – масса выделившегося на катоде никеля, г; I – сила тока, А;
t – время, сек; A – |
атомная масса никеля, г/моль; F – число Фарадея, |
||||||
95600 |
Кл/моль; |
n – число электронов, |
участвующих |
в полуреакции |
|||
восстановления ионов никеля на катоде: Ni2+(р-р) + 2е- = Ni(кр) |
n = 2. |
||||||
|
Удельные энергозатраты определяют по формуле: |
|
|||||
|
|
W = |
|
|
|
, Вт сек/г |
|
|
|
|
|
|
|
||
|
|
|
|
|
|||
где U – |
напряжение, В; I – сила тока, А; t – время, сек |
|
|||||
∆mNi – масса выделившегося на катоде никеля, г |
|
||||||
Остаточную концентрацию ионов никеля в сточной воде определяют следующим образом:
Xi = 


– объём сточной воды, взятый для электролиза, мл ∆mNi – масса выделившегося на катоде никеля, г/л
Сделайте выводы на основе результатов эксперимента.
22
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Дайте определения: окислитель, восстановитель, окислительное число
(степень окисления).
2.Что такое реакция окисления-восстановления?
3.Что такое полуреакции окисления и восстановления?
4.Приведите условия протекания окислительно-восстановительной реакции в водных растворах.
5.Что такое окислительно-восстановительный потенциал полуреакции?
6.Приведите уравнение Нернста для окислительно-восстановительного электрода.
7.Дайте определения: электролиты, электрод, анод, катод, электролизёр.
8.Обоснуйте законы Фарадея, приведите математические выражения этих законов.
9.Дайте определения: перенапряжение, плотность тока, выход по току.
23
ВАРИАНТЫ САМОСТОЯТЕЛЬНЫХ ЗАДАНИЙ Вариант 1.
1.Докажите, какое из соединений является наиболее сильным восстановителем. Расположите соединения по возрастанию
восстановительной способности в ряд.
0 |
|
2+ |
0 |
|
2+ |
Mg (E |
Mg |
/Mg = - 2,37 B) |
Pb (E |
Pb |
/Pb = - 0,13 B) |
0 |
2+ |
0 |
2+ |
||
Ni (E |
Ni |
/Ni = - 0,23 B) |
Fe (E |
Fe |
/Fe = - 0,44 B) |
2. Докажите, сколько молекул окислителя участвует в реакции: K2Cr2O7 + FeCl3 + HCl → CrCl3 + FeCl3 + KCl + H2O
Вариант 2.
1.Докажите, какой анион в кислой среде является наиболее сильным окислителем: NO3-, Cr2O72-, MnO4-, Br03-
E0 |
(NO3-/NO2) = + 0,80 B |
E0 (Cr2O72-/2Cr3+) = +1,33 B |
E0 |
(MnO4-/Mn2+) = +1,51 B |
E0 (Br03-/Br-) = +1,45 B |
2. Докажите, какое количество ионов Н+ участвуют в реакции: Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
Вариант 3.
1.Докажите, какой ион можно окислить дихроматом калия в кислой среде E0 (Cr2O72-/2Cr3+) = +1,36 B
|
Вr- → BrO3- |
(E0 = +1,24 B) |
Mn2+ → MnO4- (E0 = +2,51 B) |
|
|
2Cl- → Cl2 |
(E0 = +1,36 B) |
2I- → I2 |
(E0 = +1,54 B) |
2. |
Докажите, сколько молекул азотной кислоты участвует в реакции: |
|||
|
HNO3 + KI + HCl → I2 + NO + H2O |
|
|
|
|
|
Вариант 4. |
|
|
1. |
Докажите, какой ион можно окислить действием хлора |
|||
E0 (2Cl- /Cl2)= +1,36 B |
|
|
||
|
Fe2+ → Fe3+ |
(E0 = +0,77 В) |
2F- → F2 |
(E0 = +2,87 В) |
|
Mn2+ → MnO4- (E0 = +1,51 В) |
Вr- → BrO3- |
(E0 = +1,45 В) |
|
24
2.Рассчитайте окислительно-восстановительный потенциал (В) пары
Mn2+/Mn при С (Mn2+) = 0,005 моль/л.
Вариант 5.
1.Докажите, какая пара обладает наиболее слабыми окислительными свойствами
MnO4-/Mn2+ |
(E0 = +1,52 B) |
Cr2O72-/2Cr3+ (E0 = +1,33 B) |
|
2BrO3-/Br2 |
(E0 = +1,52 B) |
Cl2/2Cl- |
(E0 = +1,36 B) |
2. Докажите, сколько молекул дихромата участвует в реакции:
Cr2O72- + I- + H+ →I2 + Cr3+ + H2O
Вариант 6.
1.Докажите, какое вещество нельзя восстановить тиосульфатом натрия
(E0 = +0,09 B)
I2→ 2I- |
|
(E0 = +0,54 B) |
|
|
Ni2+ → Ni (E0 = -0,23 B) |
|||
2. Докажите, в каком направлении будет протекать реакция |
||||||||
Fe3+ |
+ Сe3+ ↔ Fe2+ |
+ Сe4+, |
|
|
|
|
||
0 |
3+ |
2+ |
0 |
4+ |
3+ |
|
|
|
если E |
Fe |
/ Fe = 0,77 В, |
E |
Сe |
/ Сe = 1,61 В |
|
||
|
|
|
|
Вариант 7. |
|
|
||
1. Докажите, какой ион можно восстановить действием иодидов |
||||||||
Е0 (I2/2I-) = +0,54 В |
|
|
|
|
|
|||
Sn4+ → Sn2+ |
(E0 = +0,15 B) |
|
MnO4- → Mn2+ |
(E0 = +1,51 B) |
||||
S4O62- → S2O32+ (E0 = +0,09 B) |
|
NO3- → NO |
(E0 = -0,14 B) |
|||||
2. Докажите, сколько молекул воды участвуют в реакции |
||||||||
Mn2+ + S2O82- + H2O → MnO4- + SO42- + H+ |
|
|
||||||
|
|
|
|
Вариант 8. |
|
|
||
1. Докажите, какой из ионов не может восстанавливать ион Cr2O72+ |
||||||||
E0 (Cr2O72-/2Cr3+) = +1,33 B |
|
|
|
|
|
|||
Fe3+ → Fe2+ |
(E0 = +0,77 B) |
Sn4+→ Sn2+ |
(E0 = +0,15 B) |
|||||
2Cl- → Cl2 |
(E0 = +1,36 B) |
2I- → I2 |
(E0 = +0,54 B) |
|||||
25
2. Докажите, сколько электронов принимает окислитель в реакции
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Вариант 9.
1.Вычислите потенциал пары (В) MnO4- → Mn2+ при С(MnO4-) = С(Mn2+);
СН+ = 1 моль/л E0 (MnO4-/Mn2+) = +1,51 B.
2.Расположите в порядке возрастания окислительной способности в водных растворах следующие соединения: Cr2O72-; Cu2+; H2O2 ; O2 ; O3 .
Вариант 10.
1.Докажите, что фторид-ион в растворе или расплаве нельзя окислить не одним из известных реагентов-окислителей.
2.Указать в каких процессах происходит окисление, а в каких восстановление азота, как изменяется степень окисления азота?
NH4+ →N2, NO3-→NO, NO2-→NO3-, NO2→NO2-
Вариант 11.
1. Расставьте коэффициенты методом полуреакций:
As2S3 + HNO3(конц.)= H3AsO4 + H2SO4 +NO
2. Может ли H2O2 в кислой среде окислить ионы Fe2+ до Fe3+?
Вариант 12.
1.В качестве реагентов восстановителей Cr (6) до Cr (3) в сточных водах цехов металлопокрытий автомобильных заводов используют: сульфат железа (2) в кислой, щелочной или нейтральной средах; пероксид водорода, гидразин:
Cr2O72- + Fe2+ + H+ → Fe3+ + Cr3+ + H2O CrO42- + Fe(OH)2 → Cr(OH)3↓ + Fe(OH)3↓
CrO42- + N2H4 → Cr(OH)3↓ + N2↑ + OH-
Cr2O72- + H2O2 + H+ → Cr3+ + H2O + O2
Подберите коэффициенты в уравнениях реакций. Докажите, какой из
восстановителей является более сильным?
26
Вариант 13.
1.Определите степень окисления серы в соединениях: SO2, H2S, Na2SO3, CS2, H2SO4, As3O3
2.Проставьте коэффициенты методом полуреакций:
N2H4 + AgNO3 + KOH = N2 + Ag + KNO3 + H2O
Вариант 14.
1.Укажите, в какой из приведенных реакций гидразин N2H4 служит окислителем и в какой восстановителем. Укажите степень окисления
азота. N2H4 + AgNO3 + KOH = N2 + Ag + KNO3 + H2O
N2H4 + Zn + KOH + H2O = NH3 + K2[Zn(OH)4]
2.Вычислите активность ионов водорода в растворе, в котором потенциал водородного электрода равен -82 мВ.
Вариант 15.
1.Определите степень окисления хрома в соединениях: К2CrO4, Cr2O3, Fe(CrO2)2, K2Cr2O7, Cr2(SO4)3, Na3[Cr(OH)6].
2.Определить направление возможного самопроизвольного протекания
реакции 2Hg + 2Ag+ = 2Ag + Hg22+ при концентрациях [Ag+] = 10-4M, [Hg22+] = 10-1M.
Вариант 16.
1. Проставьте коэффициенты методом полуреакций: KMnO4 + H2O2 = MnO2 + KOH + O2 + H2O
2.Установите, в каком направлении возможно самопроизвольное протекание реакции 2NaCl + Fe2(SO4)3 = 2FeSO4 + Cl2 + Na2SO4
Вариант 17.
1.Вычислите потенциал водородного электрода погруженного в чистую воду; в раствор с рН=3,5.
2.Проставьте коэффициенты методом полуреакций:
HBr + H2SO4(конц.) = Br2 + SO2 + H2O
27
Литература
1.Глинка Н.Л. Общая химия: учебник для вузов / Н.Л.Глинка. –
Л.:Химия, 2000. – 704 с.
2.Глинка Н.Л. Задачи и упражнения по общей химии / Н.Л.Глинка; под ред. В.А.Рабинович. – М.: Интграл-пресс, 2003. – 240 с.
3.Кузьменко Н.Е. Начала химии: учебное пособие / Н.Е.Кузьменко, В.В.Еремин, В.А.Попков. – М.: Экзамен, 2004. – 383 с.
4.Коржуков Н.Г. Общая и неорганическая химия / Н.Г. Коржуков; под ред. В.И. Деляна. – М.: МИСИС: ИНФРА – М, 2004. – 512 с.
5.Яблоков В.А. Химия. Получение и превращения вещества и энергии: учебное пособие / В.А.Яблоков. – Н.Новгород: ННГАСУ, 2009. – 148 с.
28
Васина Янина Александровна
Учебно-методическое пособие к выполнению лабораторных работ по химии для студентов ННГАСУ направления 05.03.06 Экология и Природопользование, направленность (профиль) Природопользование
Подписано к печати |
|
. Формат |
60х901/16, Бумага газетная. Печать трафаретная. Уч. |
изд. л 1,6. Усл. печ. л 1,8. Тираж 200 |
экз. Заказ . |
||
__________________________________________________________________
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Нижегородский государственныйархитектурностроительный университет», 603950, Н.Новгород, Ильинская, 65.
Полиграфический центр ННГАСУ, 603950, Н.Новгород, Ильинская, 65.
