
1297
.pdf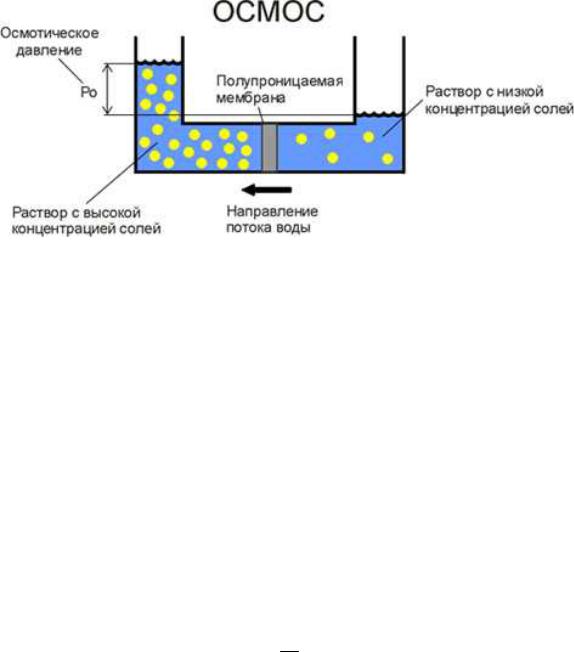
Осмотическое давление
Осмос - это односторонняя диффузия молекул растворителя через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
Рис.2 Явление осмоса
Осмотическая ячейка представляет собой два объема, разделенные полупроницаемой перегородкой. В одном из объемов находится растворитель (например, вода), в другом — раствор; или растворы с различной концентрацией. Полупроницаемая перегородка обладает свойством пропускать молекулы растворителя и не пропускать молекулы (ионы) растворенного вещества. В результате односторонней диффузии растворитель переходит в объем раствора с большей концентрацией растворенного вещества, разбавляя его. Это явление создает давление, которое можно определить по высоте столба раствора (Ро).
Согласно принципу Вант-Гоффа: Осмотическое давление раствора равно такому давлению, которое создавало бы растворенное вещество в объеме раствора, если бы оно находилось в газообразном состоянии.
Так как для газа
PV = m × RT ,
M
то согласно закону Вант-Гоффа:
Pосм = СМ × R ×T ,
где См - молярная концентрация раствора (число моль вещества на 1 л раствора); R - универсальная газовая постоянная, равная 0,082
11
(л·атм/моль·К); T - абсолютная температура, Росм – осмотическое давление раствора.
Растворы с одинаковым осмотическим давлением (греч. tónos - напряжение) - изотонические растворы - Растворы, в которых осмотическое давление жидкости, контактирующей с
мембраной, больше осмотического давления внутримембранной жидкости - гипертонические растворы Растворы, в которых осмотическое давление жидкости, контактирующей с
мембраной, меньше осмотического давления внутримембранной жидкости - гипотонические растворы
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Вода выходит из неё путём осмоса через плазматическую мембрану, если клетка находится в контакте с гипертоническим раствором. Протопласт (живое содержимое клетки) при этом уменьшается в объёме, сморщивается и в конце концов отстаёт от клеточной стенки. Этот процесс называют плазмолизом. Процесс плазмолиза обычно обратим. Если клетку поместить в чистую воду или гипотонический раствор, вода путём осмоса поступает в клетку. Протопласт при этом увеличивается в объёме и оказывает давление на сравнительно жёсткую клеточную стенку. Этот процесс называется тургором. Тургорное давление препятствует дальнейшему поступлению воды в клетку. Именно тургорное давление поддерживает стебли растений в вертикальном положении, придаёт растениям прочность и устойчивость. Изотонические растворы не оказывают влияния на водный режим клетки. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
У животных клеток нет клеточной стенки, поэтому они более чувствительны к осмотическому давлению жидкости, в которой находятся. Животные клетки имеют систему защиты, основанную на осморегуляции; организм животного стремится поддерживать осмотическое давление всех тканевых жидкостей на постоянном уровне. Например, осмотическое давление крови человека – 800 000 Н/м2. Такое же осмотическое давление имеет 0,9 %-ный раствор хлорида натрия. Физиологический раствор, изотоничный крови, широко применяется в медицине.
12

Определение молярных масс неэлектролитов по свойствам их растворов
Коллигативные свойства растворов играют большую роль в жизни и технике. По величинам этих свойств можно определять молярные массы веществ (т.к. в формулы входят величины концентраций). Из уравнений (1 - 4) получаем:
Dtкип |
= Е × Cm |
= Е × |
m |
р.в. |
; |
|
М × m р− ля |
||||||
|
|
|
|
|||
Dt зам |
= К × Cm |
= К × |
m |
р.в. |
; |
|
М × m р− ля |
||||||
|
|
|
|
|||
Pосм = СМ |
× R ×T = |
m р.в. |
× RT , |
|
|||
|
|
М р.в ×V |
|
Р = Р0 × |
n1 |
; |
n1 + n2 |
М = |
Е × m р.в. ×1000 |
г / моль ; (5) |
Dtкип × m р− ля |
М = |
К × m р.в. ×1000 |
г / моль (6) |
|
Dt зам × m р− ля |
|||
|
|
М = |
m |
р.в. |
× R ×T |
|
|
|
|
|
г / моль |
(7) |
|
|
|
|
|||
|
|
Pосм ×V |
|
||
М = (P0 - P) × n1 г / моль (8)
P × n2
где mр.в. и mр-ля - массы растворенного вещества и растворителя (г); M - молярная масса растворенного вещества; V- объем раствора (л); n1 и n2 - молярные доли растворенного вещества и растворителя, соответственно.
Следует, однако, отметить, что найденные по этим формулам величины не являются точными, т.к. формулы верны для идеальных растворов (подобных газовым растворам); на самом же деле растворы отклоняются от идеальных, причем тем больше, чем больше их концентрация.
13
Лабораторная работа №1.
Приготовление раствора соды заданной концентрации
Цель работы: приготовить раствор соды заданной концентрации и титрованием определить точную концентрацию этого раствора.
Выполнение работы:
1.Получите у преподавателя задание.
2.Используя формулы (), рассчитайте массу соды, которая должна содержаться в 250 мл раствора, чтобы он имел концентрацию, заданную преподавателем.
3.Используя формулу(), рассчитайте объем 1% раствора соды, в котором эта масса заключена.
4.Рассчитанный объем раствора соды отберите мерным цилиндром на 25, 50 или 100 мл (точность 0,5 мл).
5.Раствор из цилиндра количественно (без потерь) перелейте в мерную колбу, доведите объем раствора в мерной колбе до метки, закройте пробкой и тщательно перемешайте.
6.Установите точную концентрацию приготовленного раствора титрованием его аликвотного объема раствором хлористоводородной кислоты точноизвестной концентрации (такой раствор называют рабочим раствором или титрантом). Для этого:
а) залейте рабочий раствор хлористоводородной кислоты в бюретку, установите уровень раствора в бюретке на нулевое деление;
б) в коническую колбу отберите мерной пипеткой 25 мл приготовленного раствора соды, добавьте в него 2 капли индикатора метилоранж, перемешайте и оттитруйте раствором хлористоводородной кислоты до изменения окраски индикатора от желтой до оранжевой;
в) измерьте по бюретке объем раствора HCl, пошедший на титрование (VHCl). Проведите минимум три параллельных титрования. Результаты запишите:
VHCl
V1 =
V2 =
14
V3 =
_________
Vср =
7. Рассчитайте эквивалентную концентрацию (нормальность) раствора соды по формуле:
VNa2CO3 × H Na2CO3 =VHCl × H HCl , где
VNa2CO3 – объем раствора соды, взятый на анализ, мл;
H Na2CO3 – нормальность раствора соды, экв/л;
VHCl – объем раствора кислоты, пошедший на титрование, мл;
H HCl – нормальность раствора кислоты, экв/л;.
15
Задачи для самоконтроля знаний
1.Смешаны равные объемы 1М раствора сульфата натрия, 0,5М раствора хлорида магния и 0,3М раствора нитрата калия. Рассчитайте молярную и эквивалентную концентрации каждого вещества в полученном растворе.
2.Рассчитайте процентную концентрацию 0,015Н раствора карбоната натрия в 250 мл (плотность 1,008 г/мл).
3.Для нейтрализации 42 мл серной кислоты потребовалось добавить 14 мл 0,3н щелочи. Определить молярность раствора серной кислоты.
4.Сколько г сульфита натрия потребуется для приготовления 5 л 8% (по массе) раствора (плотность равна 1,075 г/мл)?
5.Найти нормальность и молярность 15% (по массе) раствора серной кислоты (плотность равна 1,10 г/л).
6.Сколько граммов 30% (по массе) раствора хлорида натрия нужно добавить к 300 г воды, чтобы получить 10% раствор соли?
7.До какого объема надо разбавить 500 мл 20% (по массе) раствора хлорида натрия (плотность 1,152 г/мл), чтобы получить 4,5% раствор (плотность 1,029 г/мл)?
8.Для нейтрализации 30 мл 0,1н раствора щелочи потребовалось 12 мл кислоты. Определить нормальность кислоты.
9.Сколько граммов соды содержится в 500 мл 0,25н растворе?
10.Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось
25мл 2н раствора щелочи. Определить эквивалентную массу кислоты.
11.Какой объем 0,1М раствора фосфорной кислоты можно приготовить из 15 мл 2,5М раствора?
12.Найти массовую долю азотной кислоты в растворе, в 1 литре которого содержится 224 г азотной кислоты (плотность 1,12 г/мл).
13.Сколько мл концентрированной соляной кислоты (плотность 1,19 г/мл), содержащей 38% (масс.) соляной кислоты, нужно взять для приготовления 1 л 2Н раствора?
14.Какой объем 10% (по массе) серной кислоты (плотность 1,07 г/мл) потребуется для нейтрализации раствора, содержащегося 16,0 г раствора едкого натрия?
15.Рассчитайте эквивалентные концентрации 0,01М растворов соляной, серной, фосфорной кислот, хлорида алюминия, сульфата натрия и бихромата калия.
16.Какой объем 6,0М раствора едкого калия нужно взять для приготовления
25мл 2,5М раствора щелочи?
17.Рассчитайте нормальность концентрированной соляной кислоты (плотность 1,18 г/мл), содержащей 36,5%(по массе) соляной кислоты.
18.Какой объем 15% (по массе) раствора серной кислоты (плотность 1,10 г/мл) потребуется для полного растворения 24,3 г магния?
19.К 500 мл 32% (по массе) азотной кислоты (плотность 1,2 г/мл) прибавили
1л воды. Чему равна массовая доля азотной кислоты в полученном растворе?
16
20.В 1 кг воды растворено 666 г КОН, плотность раствора равна 1,395 г/мл. Найти: а) массовую долю, б) молярность, в) мольные доли щелочи и воды.
21.Какой объем 0,2н раствора щелочи потребуется для осаждения в виде гидроксида железа всего железа, содержащегося в 100 мл 0,5н раствора хлорида железа?
22.Какой объем 2М раствора карбоната натрия надо взять для приготовления
1л 0,25Н раствора?
23.Для полного осаждения сульфата бария из 100 г 15% (по массе) раствора хлорида бария потребовалось 14,4 мл серной кислоты. Найти нормальность раствора серной кислоты.
24.Сколько граммов 2% (по массе) раствора нитрата серебра дадут при взаимодействии с избытком хлорида натрия 14.35 г осадка хлорида серебра?
25.К 100 мл 96% (по массе) серной кислоты (плотность 1,84 г/мл) прибавили
400мл воды. Получился раствор с плотностью равной 1,220 г/мл. Вычислить эквивалентную концентрацию и массовую долю серной кислоты.
26.Для нейтрализации 20 мл 0,1н раствора кислоты потребовалось 8 мл раствора едкого натрия. Сколько граммов щелочи содержит 1 л этого раствора?
27.Сколько мл 96% (по массе) раствора серной кислоты (плотность 1,84 г/мл) нужно взять для приготовления 1 л 0,25н раствора?
28.Рассчитайте, какой объем воды надо добавить к 200 мл 45% раствора едкого калия (плотность 1,5 г/мл), чтобы получить 2,0% раствор?
29.Сколько мл 0,5М раствора серной кислоты можно приготовить из 15 мл 2,5М раствора?
30.Сколько граммов карбоната кальция выпадает в осадок, если к 400 мл 0,5Н раствора хлорида кальция прибавить избыток раствора соды?
17
Тест
1. Температура кипения 10%-ных(по массе) растворов СН3ОН (t1) и С2Н5ОН
(t2):
1) t1 > t2 ; |
2) t1 < t2; |
3) t1 = t2. |
2. В 250 г органического растворителя содержится q г растворенного неэлектролита с молекулярной массой М. Криоскопическая постоянная
растворителя равна К. Выражение для |
tкрист равно: |
||
1) К· q/М; |
2) 4К· q/М; |
3) |
К· q/4М . |
3. К 100мл 0,5М водного раствора сахарозы С12Н22О11 добавлено 300мл воды. Осмотическое давление полученного раствора при 25°С равно (кПа):
1) 307,5; |
2) 309,5; |
3) 410,7; |
4) 427,5 |
4. В 200г воды растворено: а) 31г карбамида СО(NH2)2; б) 90 г глюкозы С6Н12О6. Температура кипения этих растворов:
1) одинаковая; |
2) выше в а); |
3) выше в б). |
5. В 60 г бензола растворено 2,09г некоторого вещества. Раствор кристаллизуется при 4,25°С. Чистый бензол кристаллизуется (К=5,1) при 5,5°С. Определить молекулярную формулу вещества , если элементный состав этого вещества (в % по массе): С – 50,69; Н – 4,23; О – 45,08. Молекулярная масса вещества (г/моль):
1) 142; |
2) 148; |
3) 154; |
4) 160. |
18
6. При 25°С осмотическое давление раствора, содержащего 2,80 г высокомолекулярного соединения в 200 мл раствора, равно 0,70 кПа. Молекулярная масса растворенного вещества (г/моль) равна:
1) 4,95·104; |
2) 5·104 ; |
3) 5,5·104; |
4) 6,5·104. |
7. Некоторый водный раствор неэлектролита кипит при 373,53К. Моляльная концентрация этого раствора (моль/ 1кг Н2О):
1) 0,1; |
2) 0,01; |
3) 1,0; |
4) 5,0. |
8. Осмотическое давление 0,5М раствора глюкозы (С6Н12О6) при 25 °С в кПа:
1) 1,24; |
2) 32,4809,5; |
3) 3,72; |
4) 4,96 |
9. Водный раствор, содержащий 3·1023 молекул неэлектролита 6250 г Н2О, кристаллизуется при температуре:
1) 273К; |
2) 269,28К; |
3) 271,14К. |
10. Температура кипения раствора сахарозы С12Н22О11 равна 101,4 °С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе
:
1) |
2,6 моль/ 1кг Н2О; 47%; |
2) 1,3 моль/ 1кг Н2О; 24%; |
3) |
0,65 моль/ 1кг Н2О; 12%; |
4) 1 моль/ 1кг Н2О; 14%. |
19
Этот раствор замерзает при температуре (°С):
1) -4,8; |
2) -3,8; |
3) -5,8; |
4) -6,8. |
11. Температура кипения раствора, содержащего100 г сахарозы С12Н22О11 в 750 г вода в °С:
1) 100,1; |
2) 100,2; |
3) 100,3; |
4) 100,4 |
12. Вычислить давление пара раствора, содержащего 45 г глюкозы С6Н12О6 6720 г воды при 25°С. Давление пара воды при 25°С составляет 3167 кПа.
1) меньше, чем для воды; |
2) больше воды; |
3) одинаковое (равное). |
13. Чему равно отношение масс формалина НСНО и глюкозы С6Н12О6, которые содержатся в равных объемах растворов, обладающих при данной температуре одинаковым осмотическим давлением:
1) 1:1; |
2) 1:2; |
3) 2:1; |
4) МНСОН : М С6Н12О6. |
14.Чем отличается по величине молярная концентрация серной кислоты от нормальной концентрации:
1) ничем; 2) в 3 раза меньше; 3) в 2 раза больше; 4) в 2 раза меньше.
15. Масса AgNO3, необходимая для взаимодействия с NaCl, содержащимся в 100 г 4% раствора равна:
1) 23,12; 2) 11,62; 3) 5,78; 4) 17,34
20
