
- •Лекция 1 предмет и значение химии
- •Основные законы химии
- •1. Атомно-молекулярное учение – теоретический фундамент химии.
- •Лекция 2 Строение атома
- •Лекция 3 Химическая связь
- •Лекции 4 Химическая термодинамика
- •Растворы электролитов. ЭлектролитическАя диссоциациЯ
- •Окислительно-восстановительные реакции
- •Электрохимические процессы и системы
Лекция 3 Химическая связь
1. Природа химической связи. Теории для объяснения химической связи базируются на кулоновских, квантовых и волновых взаимодействиях атомов. Прежде всего они должны объяснить выигрыш энергии при образовании молекул, механизм возникновения химической связи, ее параметры и свойства молекул.
Образование химической связи – процесс энергетически выгодный, сопровождается выделением энергии. Это подтверждено квантово-механическим расчетом взаимодействия двух атомов водорода при образовании молекулы (Гейтлер, Лондон). По результатам расчета выведена зависимость потенциальной энергии системы Е от расстояния между атомами водорода r (рис. 4).

Рис. 4. Зависимость энергии от межядерного расстояния.
При сближении атомов между ними возникают электростатические силы притяжения и отталкивания. Если сближаются атомы с антипараллельными спинами, вначале преобладают силы притяжения, поэтому потенциальная энергия системы понижается (кривая 1). Силы отталкивания начинают преобладать при очень малых расстояниях между атомами (ядерные взаимодействия). При некотором расстоянии между атомами r0энергия системы минимальна, поэтому система становится наиболее устойчивой, возникает химическая связь и образуется молекула. Тогдаr0– межъядерное расстояние в молекуле Н2, которое и есть длина химической связи, а понижение энергии системы приr0– энергетический выигрыш при образовании химической связи (или энергия химической связиЕсв). Следует отметить, что энергия диссоциации молекулы на атомы равнаЕсвпо величине и противоположна по знаку.
Для квантово-механического описания химической связи применяют два взаимодополняющих метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
2. Метод валентных связей (ВС). Ковалентная связь. Основным универсальным типом химической связи является ковалентная связь. Рассмотрим механизм образования ковалентной связи по методу ВС (на примере образования молекулы водорода):
1. Ковалентная связь между двумя взаимодействующими атомами осуществляется образованием общей электронной пары. Каждый из атомов предоставляет на образование общей электронной пары один неспаренный электрон:
Н+НН:Н
Таким образом, по методу ВС химическая связь двухцентровая и двух-электронная.
2. Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами:
Н+ННН.
3. При образовании ковалентной связи происходит перекрывание электронных облаков:

Это подтверждено экспериментально определенным значением межъядерного расстояния в молекуле Н2,r=0,074 нм, что значительно меньше суммы радиусов двух свободных атомов водорода, 2r=0,106 нм.
В области перекрывания облаков электронная плотность максимальна, т.е. вероятность пребывания двух электронов в пространстве между ядрами значительно больше, чем в других местах. Возникает система, в которой два ядра электростатически взаимодействуют с парой электронов. Это приводит к выигрышу в энергии, и система становится более устойчивой, образуется молекула. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Донорно-акцепторный механизм ковалентной связи.Образование ковалентной связи может происходить за счет собственной неподеленной пары электронов одного атома (иона) –донораи свободной атомной орбитали другого атома (иона) –акцептора. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Образование молекулы аммиака NН3 происходит обобществлением трех неспаренных электронов атома азота и одного неспаренного электрона трех атомов водорода с образованием трех общих электронных пар. В молекуле аммиака NН3 у атома азота есть собственная неподеленная пара электронов. 1s–атомная орбиталь иона водорода Н+ не содержит электронов (вакантная орбиталь). При сближении молекулы NН3 и иона водорода происходит взаимодействие неподеленной электронной пары атома азота и вакантной орбитали иона водорода с образованием химической связи по донорно-акцепторному механизму и катиона NH4+. Благодаря донорно-акцепторному механизму валентность азота В=4.
Образование химических связей по донорно-акцепторному механизму – весьма распространенное явление. Так, химическая связь в координационных (комплексных) соединениях образуется по донорно-акцепторному механизму (см. лекцию 16).
Рассмотрим в рамках метода ВС характерные свойства ковалентной связи: насыщенность и направленность.
Насыщенностьсвязи – это способность атома участвовать только в определенном числе ковалентных связей. Насыщенность определяется валентностью атома. Насыщенность характеризует количество (число) химических связей, образуемых атомом в молекуле, и это число называется ковалентностью (или, как в методе МО, порядком связи).
Валентность атома – понятие, широко используемое в учении о химической связи. Под валентностью понимают сродство, способность атома к образованию химических связей. Количественная оценка валентности при разных способах описания молекулы может отличаться. По методу ВС валентность атома (В) равна числу неспаренных электронов. Например, из электронно-ячеечных формул атомов кислорода и азота следует, что кислород двухвалентен (2s22p4), а азот трехвалентен (2s22p3).
Возбужденное состояние атомов (в.с.). Спаренные электроны валентного уровня при возбуждении могут расспариваться, и переходить на свободные атомные орбитали (АО) более высокого подуровня в пределах данного валентного уровня. Например, для бериллия в невозбужденном состоянии (н.с.) В=0, т.к. на внешнем уровне нет неспаренных электронов. В возбужденном состоянии (в.с.) спаренные электроны 2s2занимают 2s1и 2p1подуровни, соответственно – В=2.
Валентные возможности р-элементов одной группы могут быть неодинаковы. Это обусловлено неодинаковым числом АО в валентном уровне у атомов элементов, расположенных в разных периодах. Например, кислород проявляет постоянную валентность В=2, так как его валентные электроны находятся на 2 энергетическом уровне, где нет вакантных (свободных) АО. Сера в возбужденном состоянии имеет максимальную В=6. Это объясняется наличием вакантных 3d-орбиталей на третьем энергетическом уровне.
Направленность ковалентной связи. Пространственное строение молекул. Наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей (АО). Поскольку АО имеют определенную форму и энергию, то их максимальное перекрывание возможно с образованием гибридных орбиталей. Гибридизация АО позволяет объяснить пространственное строение молекул, поэтому ковалентная связь характеризуется направленностью.
3. Гибридизация атомных орбиталей и пространственное строение молекул. Часто атомы формируют связи электронами разных энергетических состояний. Так, у атомов бериллия Ве (2s12р1), бора В (2s12р2), углерода С (2s12р3) в образовании связей принимают участиеs- ир-электроны. Несмотря на то, чтоs- ир-облака отличаются по форме и энергии, химические связи, образованные с их участием, оказываются равноценными и расположены симметрично. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи. Ответ на него дает представление о гибридизации валентных орбиталей.
Согласно теории гибридизациихимические связи формируют электроны не «чистых», а «смешанных», так называемыхгибридных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) изменяются и образуются АО новой, но уже одинаковой формы и энергии. При этомчисло гибридных орбиталей равно числу атомных орбиталей,из которых они образовались.

Рис. 5. Типы гибридизации валентных орбиталей.
Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют геометрию молекул. Так, при sр-гибридизации АО бериллия Ве возникают две sр-гибридные АО, расположенные под углом 180° (рис. 5), отсюда и связи, образуемые с участием гибридных орбиталей, имеют валентный угол 180°. Поэтому молекула ВеCl2 имеет линейную форму. При sр2-гибридизации бора В образуется три sр2-гибридных орбитали, расположенные под углом 120°. Вследствие этого молекула ВCl3 имеет тригональную форму (треугольник). При sр3-гибридизации АО углерода С возникают четыре гибридных орбитали, которые симметрично ориентированы в пространстве к четырем вершинам тетраэдра, поэтому молекула ССl4 имеет также тетраэдрическую форму. Тетраэдрическая форма характерна для многих соединений четырехвалентного углерода. Вследствие sр3-гибридизации орбиталей атомов азота и бора тетраэдрическую форму имеют также NН4+ и ВН4–.
Дело в том, что центральные атомы этих молекул, соответственно, атомы С, Nи О, образуют химические связи за счетsр3-гибридных орбиталей. У атома углерода на четыреsр3-гибридных орбитали приходится четыре неспаренных электрона. Это определяет образование четырех связей С-Н и расположение атомов водорода в вершинах правильного тетраэдра с валентным углом 109°28. У атома азота на четыреsр3-гибридных орбитали приходится одна неподеленная электронная пара и три неспаренных электрона. Электронная пара оказывается несвязывающей и занимает одну из четырех гибридных орбиталей, поэтому молекула Н3Nимеет форму тригональной пирамиды. Из-за отталкивающего действия несвязывающей электронной пары валентный угол в молекулеNH3меньше тетраэдрического и составляет 107,3°. У атома кислорода на четыреsр3-гибридных орбитали приходится две несвязывающие электронные пары и два неспаренных электрона. Теперь уже две из четырех гибридных орбитали заняты несвязывающими электронными парами, поэтому молекула Н2О имеет угловую форму. Отталкивающее действие двух несвязывающих электронных пар проявляется в большей степени, поэтому валентный угол искажается против тетраэдрического еще сильнее и в молекуле воды составляет 104,5° (рис. 6).
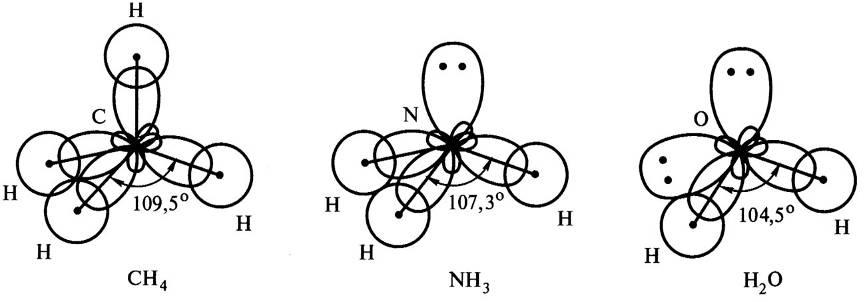
Рис. 6. Влияние несвязывающих электронных пар центрального атома на геометрию молекул.
Таким образом, метод ВС хорошо объясняет нысыщенность и направленность химических связей, такие количественные параметры, как энергия (E), длина химических связей (l) и валентные углы () между химическими связями (строение молекул). Это удобно и наглядно демонстрируется на шарико-стержневых моделях атомов и молекул. Метод ВС хорошо объясняет и электрические свойства молекул, характеризующиеся электроотрицательностью атомов, дипольным моментом молекул. Под электроотрицательностью атомов понимается их способность быть более положительными или отрицательными при образовании химической связи, или иными словами способность притягивать или отдавать электроны, образуя анионы и катионы. Первая количественно характеризуется потенциалом ионизации (EП.И), вторая – энергия сродства к электрону (EС.Э).
Таблица 3
Пространственная конфигурация молекул и комплексов АВn
|
Тип гибридизации центрального атома А |
Число электронных пар атома А |
Тип молекулы |
Пространственная конфигурация |
Примеры | |||
|
связы-вающих |
несвязывающих | ||||||
|
sр |
2 |
0 |
АВ2 |
Линейная |
BeCl2(г), CO2 | ||
|
sр2 |
3 |
0 |
АВ3 |
Треугольная |
BCl3, CO32– | ||
|
|
2 |
1 |
АВ2 |
Угловая |
O3 | ||
|
sр3 |
4 |
0 |
АВ4 |
Тетраэдрическая |
CCl4, NH4, BH4 | ||
|
|
3 |
1 |
АВ3 |
Тригонально-пирамидальная |
H3N, H3P | ||
|
|
2 |
2 |
АВ2 |
Угловая |
H2O | ||
|
sр3d |
5 |
0 |
АН5 |
Тригонально-бипирамидальная |
PF5, SbCl5 | ||
|
|
4 |
1 |
АВ4 |
Искаженная тетраэдрическая |
SF4 | ||
|
|
3 |
2 |
АВ3 |
Т-образная |
ClF3 | ||
|
|
2 |
3 |
АВ2 |
Линейная |
XeF2 | ||
|
sр3d2 |
6 |
0 |
АВ6 |
Октаэдрическая |
SF6, SiF62– | ||
|
|
5 |
1 |
АВ5 |
Квадратно-пирамидальная |
IF5 | ||
