
- •ТЕОРИЯ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ ОРГАНИЧЕСКОГО СИНТЕЗА
- •Целью дисциплины является изучение теоретических основ химико- технологических процессов тонкого органического, основного и
- •Структура дисциплины
- •ЛИТЕРАТУРА
- •ЛИТЕРАТУРА
- •8.Жоров Ю.М. Кинетика промышленных органических реакций. – М.: Химия, 1989. – 384 с.
- •ВВЕДЕНИЕ
- •Электронное строение атома углерода
- •sp3-Гибридизация АО атома углерода
- •Взаимодействие sp3 гибридизованных АО с образованием -связи (H3C-CH3 – этан)
- •Взаимодействие sp2 гибридизованных АО с образованием - и -связей
- •Взаимодействие sp1 гибридизованных АО с образованием - и -связей
- •Взаимодействие 2pz орбиталей с образованием сопряженных -связей
- •Взаимодействие 2pz орбиталей с образованием сопряженных -связей
- •СОПРЯЖЕНИЕ
- •СОПРЯЖЕНИЕ
- •Свойства -орбиталей
- •АРОМАТИЧНОСТЬ
- •АРОМАТИЧНОСТЬ
- •Энергетические критерии
- •Однако этот подход оказался неприемлемым, так как при увеличении размеров -электронной системы он
- •Эти характеристики позволяют выстроить шкалу ароматичности
- •Для удобства сравнения молекул с различным количеством-электронов удобно использовать удельную дьюаровскую энергию резонанса
- •Геометрические критерии
- •Это недостаток был учтен при разработке критерия, называемого
- •Это уравнение можно разбить на составляющие:
- •Таблица. Значения НОМА органических соединений, рассчитанные на основе экспериментальных данных
- •Магнитные критерии
- •[18]Аннулен имеет 2 сигнала в спектре 1Н ЯМР: 9,25 и -2,88 м.д.
- •В 1996 Шлейером с соавторами был предложен критерий ароматичности: ядерно-независимый химический сдвиг -
- •Таблица.
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •Графен является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную
- •АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- •Альтернантные и неальтернантные системы

Взаимодействие sp2 гибридизованных АО с образованием - и -связей
|
H |
1.37 |
|
H |
|||
|
|
|
|
|
|||
|
|
C |
|
C |
|||
|
H |
Å |
|||||
|
|
|
|
|
H |
|
|
|
|
|
|
-связь |
|
|
-связь |
-связь, |
|
|
|
||||
|
|
|
|
|
|
|
|
sp2-s |
|
|
|
|
|
|
|
|
|
-связь |
|
|
-связь, |
|
|
|
|
sp2-sp2 |
|
|
|
|
|
|
|
-связь |
|
|
|
|
|
|
|
|
|
|
|
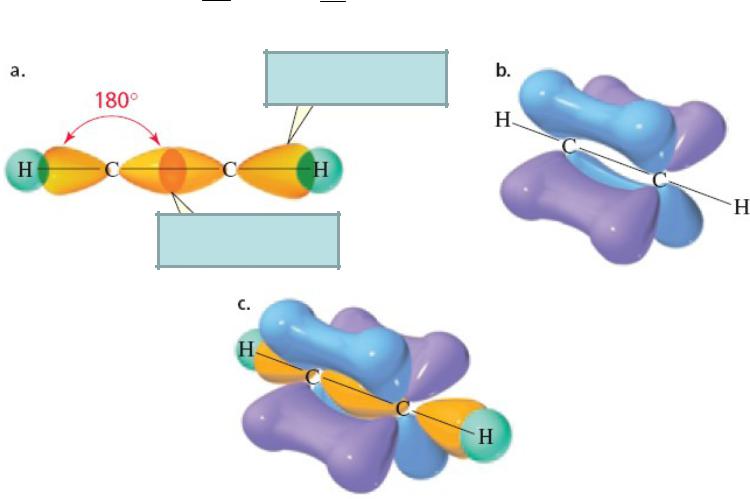
Взаимодействие sp1 гибридизованных АО с образованием - и -связей
1.33
H CÅ C H Ацетилен
C H Ацетилен
-связь, sp-s
-связь, sp-sp

Взаимодействие 2pz орбиталей с образованием сопряженных -связей
Энергия p-АО
Этилен
-MO Энергетические
Бутадиен уровни

Взаимодействие 2pz орбиталей с образованием сопряженных -связей
H2C CH CH
CH CH CH CH
CH CH CH2
CH2
1,3,5-гексатриен
Энергия p-АО
Энергетические-MO уровни

СОПРЯЖЕНИЕ
Формальным признаком сопряжения является чередование одинарных и двойных связей.
H2C CH CH
CH CH CH CH
CH CH CH2
CH2
гексатриен-1,3,5
бензол

СОПРЯЖЕНИЕ
Формальным признаком сопряжения является чередование одинарных и двойных связей.
H2C CH CH
CH CH CH CH
CH CH CH2
CH2
гексатриен-1,3,5
бензол
CH2  CH CH
CH CH CH CH3
CH CH3
пентадтен-1,3
Нарушение сопряжения
CH2  CH CH2 CH
CH CH2 CH CH2
CH2
пентадтен-1,4
Свойства -орбиталей
1.Боковое перекрывание рz-АО;
2.Эффективность перекрывания -связи меньше, чем в случае-связи; => -связь менее прочна, чем -связь.
Энергия связи: |
этилен |
598 |
кДж/моль, |
|
этан |
347 |
кДж/моль |
|
|
------------- |
|
|
|
251 |
кДж/моль. |
3.Сильная зависимость перекрывания от планарности молекулы;
4.Возможность формирования протяженных сопряженных систем;
5.-Электроны более подвижны, чем -электроны;
6.-Электронная плотность локализована над и под плоскостью молекулы. => Склонность к взаимодействию с электронодефицитными реагентами.

АРОМАТИЧНОСТЬ
Термин введен Ф. А. Кекуле (1865) для описания свойств соединений, структурно близких к бензолу - родоначальнику класса ароматических соединении.
Фридрих Август Кекуле фон Штрадониц (нем. Friedrich August Kekulé von Stradonitz,
7 сентября 1829, Дармштадт —
13 июля1896, Бонн) — немецкий химик- органик, создатель теории валентности.
Kekule’s students received three of the first five Nobel Prizes in chemistry: Van’t Hoff in 1901, Fischer in 1902 and Baeyer in 1905.
АРОМАТИЧНОСТЬ
Одним из фундаментальных понятий органической химии является
ароматичность. Термин ароматичность или ароматический характер ассоциируют со свойствами соединений, которые в основном состоянии имеют циклическую -электронную систему, включающую (4n + 2) электронов, и которые
-более устойчивы, чем их ациклические аналоги;
-характеризуются связями, длины которых лежат между длинами типично одинарной и типично двойной связей;
-обнаруживают -электронный кольцевой ток, который индуцируется, когда система подвергается воздействию внешнего магнитного поля, приводящий к возрастанию величин магнитной восприимчивости и специфическим
химическим сдвигам в спектрах 1Н ЯМР; - проявляют особую реакционную способность, заключающуюся в
склонности ароматических соединений вступать в реакции замещения, а не присоединения.
Ароматичность – это свойство, которое нельзя непосредственно измерить. В связи с этим были разработаны различные критерии (индексы) для
оценки ароматического характера. Наибольшее распространение получили энергетические, геометрические и магнитные критерии.
Энергетические критерии
Основаны на сравнении -электронной энергии ароматической и модельной молекулы. Для расчета этих критериев достаточно использовать методы, основанные на -электронном приближении.
Энергия делокализации (ЭД) или энергия резонанса
рассчитывается как разность между -электронной энергией молекулы и энергией соответствующего количества изолированных двойных связей. Эта разность характеризует выигрыш в энергии за счет делокализации -электронов.
ЭД = E - nEC=C
По данным простого метода Хюккеля для бензола E =6 + 8 .-Электронная энергия изолированной двойной связи EC=C = 2 + 2 . Тогда энергия делокализации будет равна:
ЭД = 6 + 8 - 3(2 + 2 ) = 2
Для циклобутадиена: E =4 + 4 , а ЭД=4 + 4 - 2(2 + 2 )=0.
