
- •Часть I. Механика 2
- •Часть II. Колебания и волны 42
- •Часть III. Молекулярная физика, термодинамика, явления переноса 62
- •Часть I. Механика
- •1. Определение углового ускорения вращающегося стрежня
- •2. Определение момента инерции стержня с грузами
- •Второй способ проверки закона
- •Литература
- •5. Бутман м.Ф., Кудин л.С. Обработка и представление результатов измерений. Методические указания к лабораторному практикуму. - Иваново 2005. 36с.
- •Теоретическое введение
- •Часть I.
- •Часть II.
- •Литература
- •Часть II. Колебания и волны
- •Теоретическое введение
- •Порядок выполнения работы
- •Теоретическое введение
- •Получим формулу для расчета скорости звука в данной работе. Скорость волны связана с длиной бегущей волны λ и с частотой ν соотношением
- •Упрощенное описание установки и процессов, в ней происходящих
- •Порядок выполнения работы
- •Контрольные вопросы и задания
- •Часть III. Молекулярная физика, термодинамика, явления переноса
- •Литература
- •Литература
Контрольные вопросы и задания
Что такое звук? Каков диапазон частот звуковых волн? От чего зависит скорость звука?
Может ли звук распространяться в вакууме? Ответ обоснуйте.
Запишите уравнение бегущей волны и поясните величины, входящие в уравнение.
Дайте определение стоячей волны. Как возникают стоячие волны?
Выведите уравнение стоячей волны.
Что такое узлы и пучности? Получите уравнения координат узлов и пучностей.
В чем отличие стоячей волны от бегущей?
Построить график стоячей волны для фиксированного момента времени t = 0, T/8, T/4, 3T/8 или T/2 (или для других моментов по указанию преподавателя).
Обоснуйте расчетную формулу для скорости звука.
Опишите экспериментальную установку и методику определения скорости звука.
Литература
1. Савельев И. В. Курс общей физики: Учебн. пособие для втузов: в 3 т. Т.1: Механика. Молекулярная физика. - 3-е изд., испр. - М.: Наука, 1986. – 432с.
2. Детлаф А. А. , Яворский Б. М. Курс физики: Учебн. пособие для втузов. - М.: Высшая школа, 1989. - 607 с. - предм. указ.: с. 588-603.
3. Майсова Н.Н. Практикум по курсу общей физики. – М.: Высшая школа, 1970
4. Лабораторный практикум по физике: Учеб. пособие для студентов втузов./ Ахматов А.С., Андреевский В.М., Кулаков А.И. и др.; Под редакцией А.С. Ахматова. – М.: Высшая школа. 1980. – 360 с.
Часть III. Молекулярная физика, термодинамика, явления переноса
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ
![]()
![]() ПО МЕТОДУ КЛЕМАНА И ДЕЗОРМА
ПО МЕТОДУ КЛЕМАНА И ДЕЗОРМА
Цель
работы –
определить отношение теплоемкостей
![]() для воздуха.
для воздуха.
Приборы и принадлежности – стеклянный баллон емкостью около 25 литров с краном, манометр, насос, соединительные трубки.
Теоретическое введение
Удельной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимой для нагревания единицы массы вещества на 1 оС(К) в данном процессе.
![]()
Молярной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимой для нагревания одного моля вещества на 1оС(К) в данном процессе.
![]()
Очевидно,
![]()
где
![]() молярная
масса вещества.
молярная
масса вещества.
Для газов принято различать теплоемкость при постоянном объеме Сv и при постоянном давлении Cp, в зависимости от процесса нагревания газа.
Согласно первому закону термодинамики количество переданной системе теплоты расходуется на увеличение внутренней энергии системы и работу расширения
dQ=dU+dA
При нагревании газа при V=const работа расширения dA=0, и все тепло идет на увеличение внутренней энергии, т.е. на нагревание газа.
При нагревании газа при P=const тепло затрачивается не только на нагревание, но и на работу расширения газа. Поэтому Сp > Сv.
Согласно кинетической теории идеального газа
![]()
где z – число степеней свободы молекулы
n – число молей газа
T –температура по шкале Кельвина
R – универсальная газовая постоянная
![]()
![]()
![]()
![]()
Соответственно: для двухатомного газа z = 5 и γ = 1,40; для многоатомного z = 6 и γ = 1,33.
Для
экспериментального определения
![]() воздуха в данной работе используется
адиабатический процесс расширения или
сжатия.
воздуха в данной работе используется
адиабатический процесс расширения или
сжатия.
Адиабатическим процессом называется процесс без теплового обмена с окружающей средой. dQ=0
Первое начало термодинамики для адиабатического процесса запишется как
0=dU+dA
или
а) dU = – dA - увеличение внутренней энергии газа (нагревание) происходит за счет работы внешних сил, совершающих сжатие газа.
б) dA = – dU – работа расширения, совершаемая газом, происходит за счет уменьшения его внутренней энергии.
Таким образом, при адиабатическом сжатии газ нагревается, при адиабатическом расширении – охлаждается.
Для осуществления адиабатического процесса нужно либо теплоизолировать систему, либо вести процесс так быстро, чтобы теплообмен не успел произойти.
Описание установки.
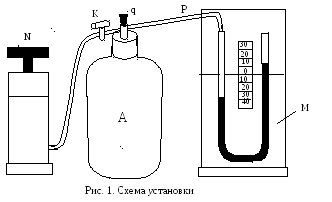
Стеклянный баллон А емкостью 25 литров с пробкой q соединен резиновыми трубками с насосом N и манометром М. На трубке, соединяющей баллон с насосом, имеется кран К (см. рис. 1).
Проведение эксперимента
I.
Определение
![]() при сжатии воздуха.
при сжатии воздуха.
1) Перед опытом открыть пробку q. Давление воздуха в баллоне А станет равным атмосферному давлению, и жидкость в манометре установится на одном и том же уровне в обоих коленах.
2) Закрыть трубку сосуда пробкой q, открыть кран К и осторожно накачать при помощи насоса N некоторое количество воздуха. Уровень жидкости в левом (соединенном с баллоном) колене начинает при этом опускаться, а в правом – подниматься.
Накачивать воздух следует до тех пор, пока разность высот уровней жидкости в манометре не достигнет нескольких десятков сантиметров ( 25 – 30 см ). (При накачивании воздух в баллоне сжимается, и температура его повышается ).
3) Закрыть кран К и дать воздуху в баллоне охладиться до комнатной температуры. Так как при охлаждении газа в баллоне его давление понижается, то разность уровней жидкости в манометре несколько уменьшается. Когда температура в баллоне станет равной температуре окружающего воздуха, перемещение уровней жидкости в манометре прекратится, и установится определенная разность высот h1 , которую отмечают по шкале манометра. Давление внутри баллона будет равно
P1 = H + h1 ,
где Н – атмосферное давление. Удельный объем газа (объем, занимаемый единицей массы газа) в баллоне будет V1, а температура t1 = tкомн . Это состояние изобразится точкой А на графике, приведенном в таблице 1.
4). Открыть и очень быстро закрыть пробку q . При этом с воздухом в баллоне произойдут два следующие друг за другом процесса:
а). В момент открытия пробки происходит быстрое расширение воздуха, заключенного в баллоне, которое можно считать адиабатическим из-за его кратковременности. Давление при этом упадет до атмосферного и будет равно Р2 = Н объем возрастает до V2 , так как часть воздуха вышла, и на единицу массы теперь приходится больший объем. Температура становится ниже комнатной t2 < t1 , так как воздух адиабатически расширился. Это второе состояние изображается на графике, приведенном в таблице 1, точкой В.
б). После закрытия пробки q через 2 – 3 минуты воздух в баллоне в результате теплообмена снова нагревается до комнатной температуры tк . В процессе теплообмена происходит изохорическое нагревание воздуха, так как удельный объем V2 остается неизменным. При этом давление воздуха возрастает до
Р3 =Н + h2.
Разность уровней h2 ( после того, как она установится ) снова отмечают по шкале манометра. Это третье состояние газа изобразится точкой С (см. тот же график и таблицу).
Состояниям А и С соответствует одна и та же температура, поэтому на графике эти точки можно соединить изотермой.
Таблица трех состояний в процессе работы не заполняется, она нужна для вывода расчетной формулы.
Таблица 1
Три состояния воздуха при сжатии и графики соответствующих переходов
-
При каких
условиях
Состоя-
ние
Уд.
объем
Давле-
ние
Темпе-
ратура
V

V
До откры-
тия пробки
А
V1
H +h1
tк
В момент
открытия
пробки
В
V2
H
t2
После
закрытия
пробки
С
V2
H + h2
tк
Таблица 2
Три состояния воздуха при расширении и графики соответствующих переходов
-
При каких
условиях
Состоя-
ние
Уд.
объем
Давле-
ние
Темпе-
ратура
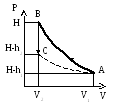
До откры-
тия пробки
А
V1
H – h1
tк
В момент
открытия
пробки
В
V2
H
tк
После
закрытия
пробки
С
V2
H – h2
tк
Вывод расчетной формулы
Рассматривая переход воздуха из состояния А в состояние В как процесс адиабатический, применим к нему уравнение Пуассона
![]()
![]()
или 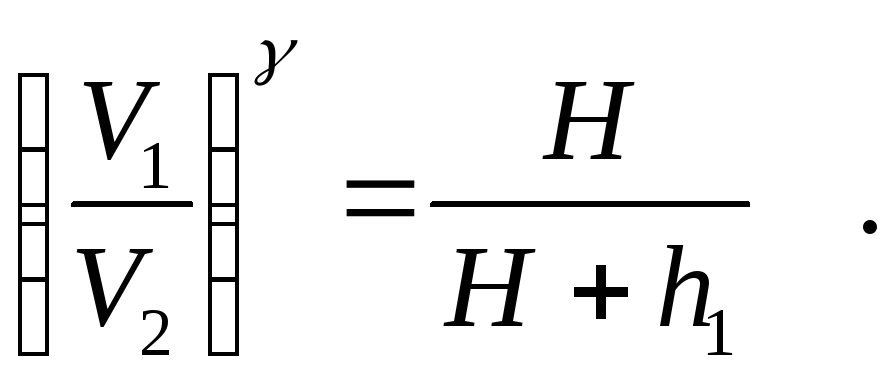 (1)
(1)
Переход от конечного состояния С к начальному состоянию А можно было бы произвести изотермически, так как температура в обоих состояниях одинаковая – tk..
Применим к этому переходу закон Бойля-Мариотта
![]() (2)
(2)
Возводя левую и правую части уравнения (2) в степень γ, получим
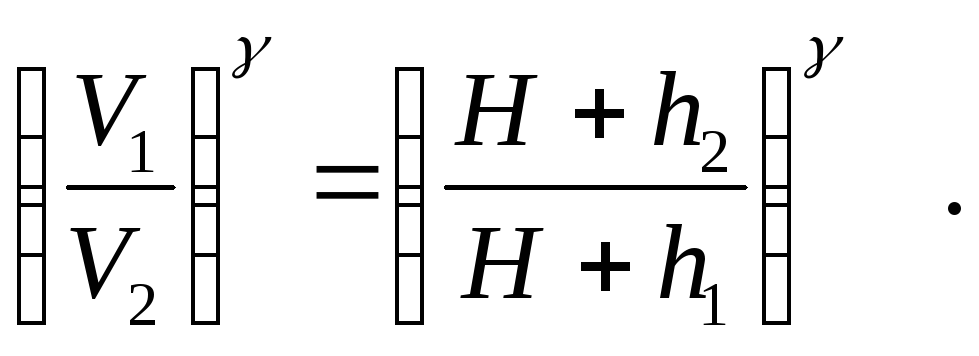 (3)
(3)
Левые части равенств (1) и (3) равны, следовательно, равны и правые
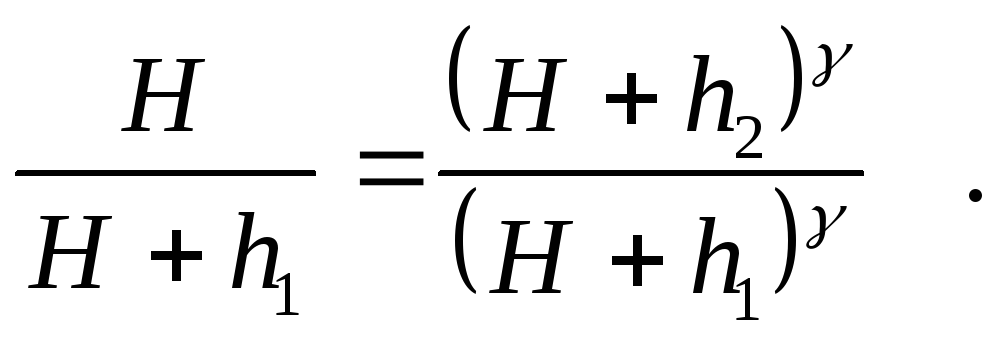 (4)
(4)
Логарифмируя (4), получим
![]()
откуда
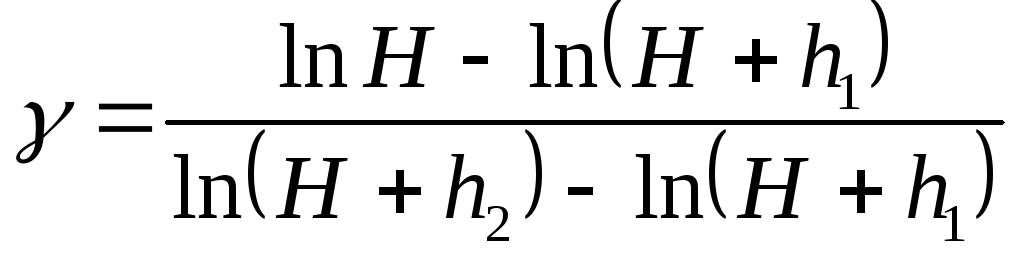
или
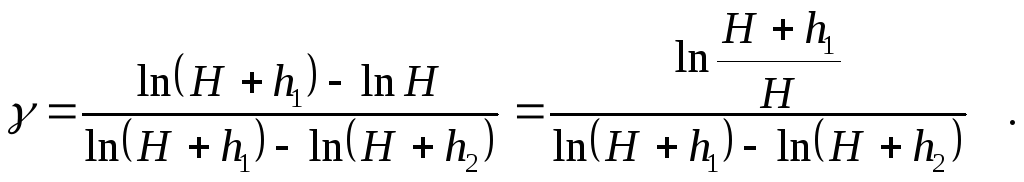
Вычитая и прибавляя в знаменателе последнего выражения ln H, получим
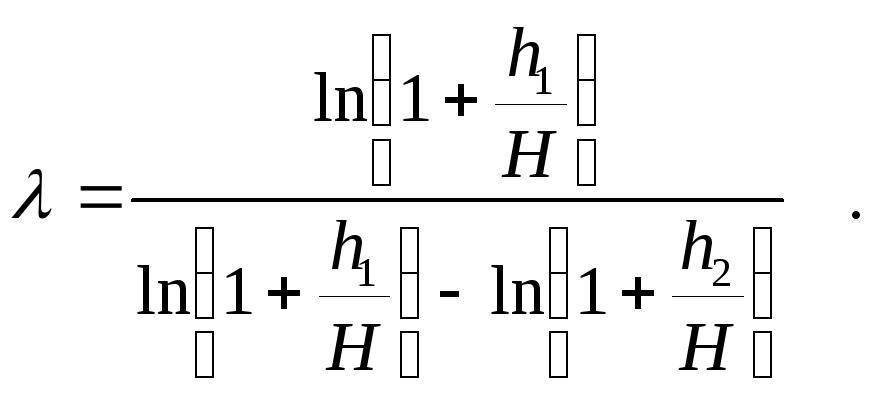
Из
теории рядов известно, что выражение
![]() может быть представлено в виде
может быть представлено в виде
![]()
Если
Х мало, то ln
![]()
В нашем случае
![]() –
достаточно малы и
–
достаточно малы и
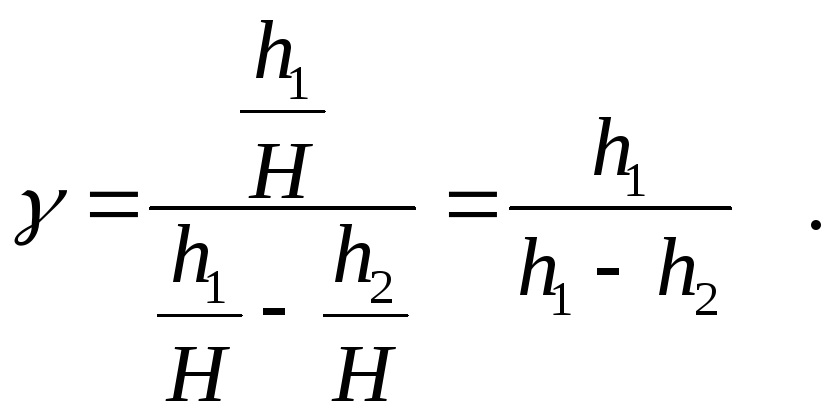
Формула
(5) позволяет определить величину
![]() по двум показаниям манометраh1
и h2
.Опыт следует провести не менее пяти
раз при различных показаниях для случаев
расширения и сжатия воздуха в баллоне.
Результаты измерений h1
и h2
занести в таблицу 3. Для каждой пары h1
и h2
по формуле (5) вычислить γ,
полученные значения занести в таблицу.
Вычислить приближенное значение γ,
абсолютную и относительную погрешности.
Окончательный результат записать в
виде
по двум показаниям манометраh1
и h2
.Опыт следует провести не менее пяти
раз при различных показаниях для случаев
расширения и сжатия воздуха в баллоне.
Результаты измерений h1
и h2
занести в таблицу 3. Для каждой пары h1
и h2
по формуле (5) вычислить γ,
полученные значения занести в таблицу.
Вычислить приближенное значение γ,
абсолютную и относительную погрешности.
Окончательный результат записать в
виде
![]()
Таблица 3
Результаты измерений и вычислений
|
|
№ п/п |
h1 |
h2 |
| |
|
Сжатие |
1 2 3 4 5 |
|
|
| |
|
Расширение |
1 2 3 4 5 |
|
|
| |
|
|
| ||||
|
|
| ||||
|
|
|
|
Приближенное значение γпр
Абсолютная погрешность ∆γ
Контрольные вопросы
1. Что называется удельной и молярной теплоемкостями? Соотношение между ними. Единицы измерения.
2. Что такое Сv и что такое Ср ? Почему Ср > Сv ?
3. Какой процесс называется адиабатическим? Как практически можно осуществить адиабатический процесс?
4. Пользуясь первым началом термодинамики и уравнением Менделеева-Клапейрона, обосновать закон Пуассона для адиабатического процесса.
5. В системе координат P и V представьте адиабату и сопоставьте с изотермой. Почему адиабата идет более круто, чем изотерма?
6. Выведите расчетную формулу Клемана и Дезорма. Какие изопроцессы имели место в данной работе?
7. Проанализировать таблицы 1 и 2 для расширения и сжатия и выяснить физический смысл процессов.
