
книги / Наноструктурированная керамика на основе диоксида титана для ортопедического этапа лечения пациентов с переломами и приобретенными дефектами челюстных костей
..pdfмии развития микроорганизмов ФГБУ «Институт экологии игенетики микроорганизмов» Уральского отделения РАН, г. Пермь (заведующий– кандидатмедицинскихнаук, доцентВ.П. Коробов).
Общая характеристика низкомолекулярного катионного пептида варнерина
Низкомолекулярный катионный пептид варнерин синтезируется бактериями Staphylococcus warneri IEGM KL-1 (штамм бактерий депонирован в Государственной коллекции патогенных микроорганизмов Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича (сейчас ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России, г. Москва) под номером 260. Варнерин обладает молекулярной массой 2999 дальтон, относится к семейству лантибиотиков. Пептид ингибирует рост широкого спектра грампозитивных бактерий различных родов и семейств – стафилококков, стрептококков, коринебактерий и бацилл (патент РФ на изобрете-
ние № 2200195 от 10.03.2003).
Варнерин является бактериоцином, провоцирующим активацию аутолизинов с лизисом бактерий чувствительных к нему видов. Характерной особенностью этого пептида является наличие в его составе дегидрированных остатков аминокислот серина и треонина, а также особых тиоэфирных аминокислот – лантионина и (или) 3-метиллантионина. Аминокислотный анализ гидролизатов гомогенного препарата пептида был изучен ранее и представлен в табл. 5.1 [6].
Суммарный положительный заряд молекул варнерина приводит к их связыванию с анионными группами клеточных оболочек бактерий, а наличие на поверхностях цитоплазматических мембран выраженных анионных зон способствует продвижению положительно заряженных молекул этого пептида внутрь клеточных стенок бактерий и сорбции на внешних поверхностях клеточных мембран. Внедряясь в их липидный матрикс, варнерин формирует нерегулируемые каналы и поры, что вызывает лизис и гибель атакованных клеток.
181
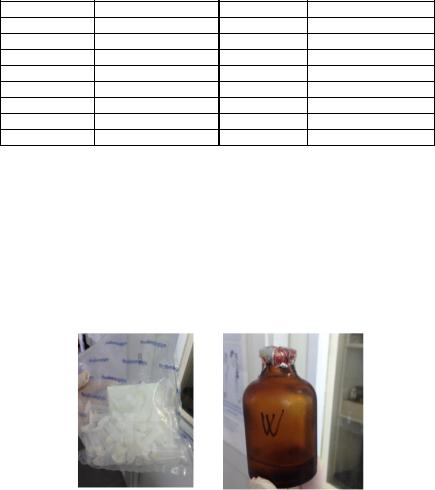
Таблица 5 . 1
Аминокислотный состав варнерина – низкомолекулярного катионного пептида, продуцируемого бактериями
S. warneri IEGM KL-1
Аминокислота |
Количество остатков Аминокислота Количество остатков |
||
Аспарагин |
0,8±0,11 |
Тирозин |
0,2±0,02 |
Серин |
1,6±0,13 |
Валин |
1,8±0,15 |
Глицин |
2,7±0,15 |
Метионин |
0,1±0,03 |
Гистидин |
0,3±0,05 |
Лантионин |
2,4±0,04 |
Аргинин |
0,3±0,28 |
Изолейцин |
1,7±0,14 |
Треонин |
4,4±0,46 |
Лейцин |
2,1±0,01 |
Аланин |
3,3±0,1 |
Фенилаланин |
0,2±0,02 |
Пролин |
0,3±0,04 |
Лизин |
6,8±0,05 |
Кроме этого, проведенные раннее исследования подтверждают механизм потенцирования варнерином действия биологически активных агентов, который обусловлен облегчением пептидом их поступления в бактериальные клетки, что значительно повышает эффективность действия лечебных препаратов и варнерина на патогенные бактерии, втомчисленаантибиотикорезистентныештаммы.
Из лиофилизированного низкомолекулярного пептида варнерина предварительно готовили стерильный водный раствор с концентрацией 120 мг/мл (рис. 5.1, а, б).
аб
Рис. 5.1. Пептид варнерин: а – лиофилизированный; б – подготовленный для эксперимента водный раствор
182

До начала экспериментов все образцы помещали по одному
виндивидуальные стеклянные флаконы и подвергали стерилизации автоклавированием при температуре 121 °С и давлении 1 атм
втечение 60 мин. Все экспериментальные данные, полученные троекратно, выражали в условных единицах (УЕ). Во всех группах экспериментов определяли биомассу и количество живых клеток
вбиопленках путем окрашивания и измерения оптической плотности.
Исследование пленкообразующих свойств S. epidermidis 33 на экспериментальных образцах из диоксида титана
При планировании данной экспериментальной части работы был использован дизайн эксперимента, представленный на рис. 5.2.
ХАРАКТЕРИСТИКА ОБРАЗЦОВ
I группа |
II группа |
III группа |
контроль, n = 6 |
эксперимент, n = 6 |
эксперимент, n = 6 |
(две подгруппы): |
(две подгруппы): |
(две подгруппы): |
– диоксид титана (n = 3) |
– диоксид титана (n = 3) |
– диоксид титана + варнерин |
– диоксид титана с нано- |
– диоксид титана с на- |
(n = 3) |
структурированной по- |
ноструктурированной |
– диоксид титана с нанострук- |
верхностью (n = 3) |
поверхностью (n = 3) |
турированной поверхностью + |
|
|
+ варнерин (n = 3) |
Стерилизация автоклавированием (121 °С, 1 атм, 60 мин) Питательная среда LB, термостат (37 °С на 48 ч)
Культура (инокулум) S. epidermidis 33 (107 КОЕ/мл) Промывание двукратное 10 ммоль фосфатным буфером (рН = 7,2)
1 мл водного раствора варнерина (120 мг/мл, 4 ч)
Промывание однократное 10 ммоль фосфатным буфером
(рН = 7,2)
Окрашивание
1.Определение биомассы (0,1%-ный генцианвиолет)
2.Определение количества живых клеток в биомассе (восстановление водорастворимого тетразолия MTS)
Рис. 5.2. Исследование возможности ингибирования образования биопленки S. epidermidis 33 на поверхности экспериментальных образцов из диоксида титана
183
В ходе эксперимента все образцы с наноструктурированной поверхностью диоксида титана и без нее были разделены на три группы:
1-я группа (контрольная), n = 6, определение сорбции красителей поверхностями керамики. Исследовали образцы диоксида титана (n = 3) и диоксида титана с наноструктурированной поверхностью (n = 3). В стерильные флаконы со стерильными таблетками вносили по 2 мл богатой питательной среды LB. Флаконы помещали в термостат (37 °С, 48 ч), затем дважды промывали 10 ммоль фосфатным буфером (рН = 7,2) и окрашивали.
2-я группа (экспериментальная), n = 6 – образцы из диоксида титана с наноструктурированным поверхностным слоем (n = 3) и без него (n = 3). Для изучения процессов пленкообразования бактериями S. epidermidis 33 во флаконы со стерильными таблетками вносили по 2 мл инокулума S. epidermidis 33 в среде LB (107 КОЕ/мл) и помещали их в термостат (37 °С, 48 ч) без смены среды. После инкубации планктонную культуру удаляли, образцы переносили в стерильные флаконы и дважды промывали 10 ммоль фосфатным буфером, после чего помещали их в новые флаконы и окрашивали (рис. 5.3).
а |
б |
Рис. 5.3. Этап эксперимента: а – до промывания образовавшейся биопленки (справа) в сравнении с контролем (слева);
б – промывание образовавшейся биопленки
3-я группа (экспериментальная), n = 6 – образцы из диоксида титана с наноструктурированным поверхностным слоем (n = 3) и без него (n = 3). Изучение антибактериального эффекта поликати-
184

онного пептида варнерина проводили после 48-часового выращивания биопленок S. epidermidis 33 и их последующей двукратной промывки фосфатным буфером. Для этого по одной таблетке помещали
встерильные флаконы, содержащие 1 мл водного раствора варнерина (120 мг/мл), на 4 ч с последующей однократной промывкой фосфатным буфером и окрашиванием.
Образцы всех вышеперечисленных групп окрашивали двумя способами для определения биомассы и количества живых клеток
вбиопленке. Изучение биомассы микробных пленок проводили путем измерения связывания клетками бактерий и матриксом биопленок красителя – 0,1%-ного раствора генцианвиолета (рис. 5.4).
Рис. 5.4. Экспериментальные образцы залиты генцианвиолетом для определения общей биомассы микробной пленки
Несвязанный краситель удаляли путем двукратного промывания буфером (рис. 5.5, а, б) с последующей экстракцией связавшегося красителя 96%-ным этанолом (рис. 5.6, б) в течение 12 ч и детекцией оптической плотности (OD) спиртового экстракта на спектрофотометре PD-303 (APEL, Япония) при длине волны 570 нм в кюветах с длиной оптического пути 0,5–1,0 см.
Количество жизнеспособных бактериальных клеток в биопленках выявляли по уровню восстановления водорастворимого тетра-
золия MTS в системе Cell Proliferation Assay (Promega, США) по прописи фирмы-производителя. Количество образовавшегося формазана измеряли на спектрофотометре СФ РД-303 при длине волны 490 нм в кюветах. Все эксперименты проведены трехкратно. Для повышения корректности сравнения полученных экспериментальных данных их выражали в условных единицах (УЕ), отражавших
185

отношение оптической плотности растворов восстановленного генцианвиолета или тетразолия на 1 см2 поверхности экспериментальных образцов.
а |
б |
Рис. 5.5. Промывание несвязанного красителя (генцианвиолета): а – однократное; б – повторное
а |
б |
Рис. 5.6. Экспериментальные образцы диоксида титана после двукратного промывания (а); экстракция экспериментальных образцов этиловым спиртом (б)
Полученные и обработанные результаты исследования пленкообразующих свойств S. epidermidis 33 на экспериментальных образцах диоксида титана с различными подходами при технологической обработке его поверхности представлены в табл. 5.2, 5.3.
Как видно из данных табл. 5.2, наноструктурированное покрытие диоксида титана не оказывало влияния на связывание красителя (формазана) контрольными таблетками в среде LB, но снижало, практически в три раза, количество живых клеток S. epidermidis 33 в биопленках после их выращивания в течение 48 ч.
186
Таблица 5 . 2
Содержание живых клеток в 48-часовых пленках S. epidermidis 33 на поверхностях диоксида титана до и после воздействия варнерином, УЕ
|
Сорбция краси- |
Сорбция форма- |
Сорбция формаза- |
Характеристика |
теля (формаза- |
на биопленками |
|
на) образцами |
зана биопленка- |
S. epidermidis 33 |
|
образцов |
ми S. epidermidis |
||
|
в среде LB |
33 (OD) (48 ч) |
(48 ч), обработан- |
|
(контроль) |
|
нымиварнерином |
Диоксид титана |
0,04 ± 0,001 |
5,57 ± 0,009 |
0,06 ± 0,042 |
Диоксид титана |
|
|
|
с наноструктуриро- |
0,042 ± 0,001 |
1,79 ± 0,043* |
0,05 ± 0,043 |
ванной поверх- |
|
|
|
ностью |
|
|
|
Примечание: * – статистическая значимость полученных результатов
(р < 0,05).
Таблица 5 . 3
Биомасса пленок S. epidermidis 33 через 48 ч роста на образцах из диоксида титана до и после воздействия варнерином, УЕ
|
|
Биопленки |
Биопленки |
|
Сорбция генци- |
S. epidermidis 33 |
|
Характеристика |
S. epidermidis |
||
образцов |
анвиолета образ- |
33 на среде |
на среде LB |
|
цами в среде LB |
LB (48 ч) |
(48 ч), обработанные |
|
|
|
варнерином |
Диоксид титана |
0,10 ± 0,002 |
1,64 ± 0,104 |
0,55 ± 0,090 |
Диоксид титана |
|
|
|
с наноструктурной |
0,25 ± 0,031* |
0,70 ± 0,124* |
0,27 ± 0,050* |
поверхностью |
|
|
|
Примечание: * – статистическая значимость относительно групп исследования (р < 0,05).
При этом важно отметить, что наномодифицированное покрытие диоксида титана не препятствует действию варнерина, а необходимое для действия количество пептида сводится к минимуму в связи с небольшим накоплением общей биомассы и небольшим количеством живых бактериальных клеток на конструкционном материале с наноструктурированной поверхностью, что является более выгод-
187

ным с точки зрения снижения количества используемого низкомолекулярного катионного пептида, необходимого для проявления его эффекта (рис. 5.7).
Рис. 5.7. Содержание живых клеток в биопленках S. epidermidis 33 (48 ч) на образцах из диоксида титана (до и после воздействия варнерином).
Здесь и на рис. 5.8: к – контроль; о – опыт; W – варнерин
Полученные данные свидетельствуют о том, что наноструктурирование поверхности диоксида титана приводит к значительному увеличению, практически в 2,5 раза, связывания красителя генцианвиолета (см. табл. 5.3). Вместе с тем такая модификация бактериями поверхности вызывала более чем трехкратное снижение атакуемой биомассы пленокS. epidermidis 33 прикультивированииихвтечение48 ч.
Рис. 5.8. Биомасса пленок S. epidermidis 33 через 48 ч роста на образцах из диоксида титана (связывание красителя генцианвиолета)
Действие варнерина было также эффективно и при формировании биопленок S. epidermidis 33 на поверхностях диоксидтитановых таблеток с наноструктурированным покрытием и без него. При этом количество необходимого для проявления эффекта варнерина в данных условиях было в 2 раза больше на образцах диоксида титана без наноструктурированного покрытия, что связано со значительно большим числом живых бактериальных клеток в исходной биопленке, в отличие от наноструктурированного диоксида титана, на поверхности которого изначально формировалась меньшая бактериаль-
188

ная масса (рис. 5.8). Для повышения информативности полученные данные представлены в сравнительном аспекте на рис. 5.9.
Рис. 5.9. Сравнение содержания живых клеток и уровня биомассы в 48-часовых биопленках S. epidermidis 33 на образцах из диоксида титана
ИсследованиепленкообразующихсвойствбактерийS. epidermidis 33 на экспериментальных образцах из материала Vertex ThermoSens, в том числе с введенным в их состав наноразмерным диоксидом титана и после обработки варнерином
Исследования проводили на образцах полиамида Vertex ThermoSens (с введением в его состав наноразмерного порошка диоксида титанаибезнего) пластинчатойформыразмером10×5×2 мм(рис. 5.10).
аб
Рис. 5.10. Образцы для исследования пленкообразования бактериями S. epidermidis 33: а – из полиамида Vertex ThermoSens; б – из полиамида Vertex ThermoSens, армированного наноразмерным диоксидом титана
189
Впредварительных экспериментах было изучено связывание красителей с материалами контрольной и опытной пластинок без микробных пленок. При этом связывание формазана контрольной пластинкой (Vertex ThermoSens), обусловленное функционированием живых клеток, составило 0,224 УЕ, опытной (Vertex ThermoSens + наноразмерный диоксид титана) – 0,227 УЕ; связывание генцианвиолета (общая биомасса пленок) в контроле – 0,59 УЕ, в опы-
те – 0,56 УЕ.
Восновной экспериментальной части работы все полиамидные образцы были разделены на две группы:
1-я группа (контрольная), n = 20 – для определения сорбции красителей поверхностью термопласта. Из них образцы из термо-
пласта Vertex ThermoSens (n = 10) и образцы из Vertex ThermoSens
с введенным в его состав наноразмерным диоксидом титана (n = 10). В стерильные флаконы со стерильными таблетками вносили по 2 мл богатой питательной среды LB. Флаконы помещали в термостат (37 °С, 48 ч), затем дважды промывали 10 ммоль фосфатным буфером (рН = 7,2) и окрашивали.
2-я группа (экспериментальная), n = 20 – образцы из термопла-
ста Vertex ThermoSens (n = 10) и образцы из Vertex ThermoSens
свведенным в его состав наноструктурированным диоксидом титана (n = 10). Для изучения процессов пленкообразования S. epidermidis 33 во флаконы со стерильными таблетками добавляли по 2 мл инокулума S. epidermidis 33 в среде LB (107 КОЕ/мл), помещали их
втермостат при температуре 37 °С на 48 ч без смены среды. После инкубации планктонную культуру удаляли, таблетки переносили
встерильные флаконы и дважды промывали 10 ммоль фосфатным буфером, после чего помещали их в новые флаконы и окрашивали.
Часть стерильных пластинок использовали для выращивания
биопленок: для этого в каждый флакон вносили по 2 мл инокулума S. epidermidis 33 в среде LB, содержащей 107 КОЕ/мл, и помещали их в термостат при 37 °С на 48 ч. По истечении времени инкубации
образцы дважды промывали 10 ммоль фосфатным буфером (pH = 7,2) и половину пластинок помещали в водный раствор пеп-
190
