
книги / Теория сварочных процессов
..pdfЗАДАНИЕ 2
Устойчивость химических соединений в условиях различных сварочных атмосфер
Задание. Рассчитать равновесное парциальное давление кислорода (упругость диссоциации) оксида при 500–3000 К согласно варианту задания и сделать выводы об устойчивости оксида в условиях различных сварочных атмосфер.
Варианты задания 2:
Вариант |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Оксид |
FeO |
NiO |
Cu2O |
CuO |
MnO |
SiO2 |
Al2O3 |
MqO |
|
|
|
|
|
|
|
|
|
Вариант |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
Оксид |
TiO |
TiO2 |
Cr2O3 |
CaO |
WO2 |
MoO2 |
VO |
ZrO2 |
Порядок проведения расчета:
1. Рассчитать упругость диссоциации оксида Ме в интервале 500…3000 К. Результаты представить в виде таблицы и графика lg (PO2, атм) = f (T(К)).
2.Определить возможность очистки поверхности металла (Ме) от оксида этого металла путем нагрева до 500…3000 К в вакууме 10–2
и10–5 мм рт. ст. и указать температуру, выше которой такая очистка возможна. (Принять PO2 = 0,21 Рвак).
3.Определить возможность образования оксида Ме в ацетиленокислородном пламени. Принять:
для окислительного пламени lg (PO2, атм) = −2…−8; для нейтрального − lg (PO2, атм) = −8…−11,5;
для науглероживающего − lg (PO2, атм) = −11,5…−17.
233

CaF2(ж) |
− 1312000 |
210 |
SF |
− 48200 |
− 12 |
CaF2 |
− 970000 |
84 |
SiF4 |
− 1665000 |
170 |
FeF2 |
− 473200 |
− 13 |
TiF3 |
− 1164000 |
45 |
MnF |
− 140000 |
− 63 |
TiF4 |
− 1566600 |
134 |
MnF2 |
− 592000 |
0,5 |
MnF3 |
− 800000 |
54 |
NaF |
− 405000 |
40 |
ZnF4 |
− 1677500 |
28 |
Листинг решения Задания 2 в Mathcad 11
Диссоциация химических соединений
|
|
Расчет упругости диссоциации оксида железа |
|
|
K |
:= P |
|
|
B |
0 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(O2) |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
dG T := −R T lnK p |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из табл. 3 задаем значения А и В и соответствующие им интервалы температур: |
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
A1 := |
−62670 |
|
B1 := 15.18 |
|
T1 := 300 , 320 .. 1180 |
|
|
T5 := 0,20 .. 3000 |
|||||||||||||||||
|
|
|
|
|
|
A2 := −62860 |
|
B2 := 15.34 |
|
T2 := 1180 ,1200 .. 1640 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
A3 := −54680 |
|
B3 := 10.38 |
|
T3 := 1640 ,1660 .. 1800 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
A4 := −57320 |
|
B4 := 11.84 |
|
T4 := 1800 , 1820 .. 3000 |
|
|
|
|
|
|
|
||||||||||||||
dG(T1) := (A1 + |
B1 T1) 4.184 |
|
|
|
lgP(T1) := |
dG(T1) |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.56 T1 |
|
|
|
|
|
|
|
|
|
|
||
dG(T2) := (A2 + |
B2 T2) 4.184 |
|
|
|
lgP(T2) := |
dG(T2) |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.56 T2 |
|
|
|
|
|
|
|
|
|
|
||
dG(T3) := (A3 + B3 T3) 4.184 |
|
|
|
lgP(T3) := |
dG(T3) |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
9.56 |
T3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
dG(T4) := (A4 |
+ B4 |
T4) 4.184 |
|
|
|
|
lgP(T4) |
:= |
dG(T4) |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
9.56 T4 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
− lgP(T2) |
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
− lgP(T3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
− lgP(T4) |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
8.883 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.883 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
5.216 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
238 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
300 |
600 |
900 |
1200 |
1500 |
1800 |
|
2100 |
|
2400 |
2700 |
3000 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 ,T3 ,T4 ,T5 |
|
|
|
|
|
|
|
|
|
|
|||||

ЗАДАНИЕ 3
Легирование металла сварного шва элементами из шлака (флюса, покрытия)
Наугл. пламя
Для сплавов на основе Fe реакцию распределения Ti между шлаком и металлом можно представить в виде
|
|
|
|
|
|
Нейтрал. пламя |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Вакуум 10–5 мм рт. ст. |
|
||||
для которой |
|
|
|
|
|
(TiO2 )+ 2Fe = 2(FeO)+ |
|
Ti |
|
, |
(1) |
||||||
|
|
||||||||||||||||
Окислит. пламя |
|
|
Вакуум 10–2 мм рт. ст. |
|
|||||||||||||
|
a(2FeO) a |
|
|
|
|
|
|
|
|
||||||||
K p = |
|
Ti |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
Арг |
|
. |
-дуг. сварка |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
a |
|
2Fe |
|
a(TiO2 ) |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||||
, |
|
|
Сварка покрытым электродом |
|
|
|
|
|
|
||||||||
где a(FeO) и a(TiO2 ) − активности оксидов в шлаке; a Ti и a Fe − активности Ti и Fe в стали (как для растворителя aFe =1).
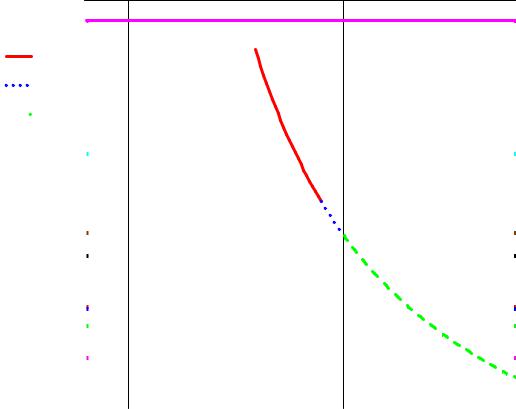
Рис. 1. Упругость диссоциации оксида железа FeO
Изменение энергии Гиббса
∆GT0 1 = −RT ln K p .
Выражая активность через мольную долю и коэффициент активности (ai = γi X i ), получим
|
|
−∆G |
|
X (2FeO) γ(2FeO) γ |
|
Ti |
|
X |
|
Ti |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
lg K1 |
= |
|
T .1 |
= lg |
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
||||||
2,3 |
R T |
γ(TiO2 ) X (TiO2 ) |
|
|
||||||||||
|
|
|
|
|
|
|||||||||
откуда искомое равновесное содержание Ti в сплаве (в мольных долях) определяем по формуле
239

