
книги / Химия водных растворов, природных и сточных вод
..pdfсеивании света коллоидными частицами. Световой луч при прохождении через коллоидный раствор представляет собой световой конус. При прохождении светового луча через истинный раствор такого явления не наблюдается.
Особенности свойств коллоидных систем и растворов объясняются строением коллоидных частиц и наличием двойного электрического слоя на границе раздела фаз.
Коллоидные частицы, обладающие большой удельной поверхностью, способны адсорбировать на своей поверхности ионы, в результате приобретая заряд. Степень адсорбции ионов зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциируемые поверхностные соединения. Установлено, что адсорбционная способность ионов повышается с увеличением радиуса иона, его валентности, поляризуемости, т.е. способности притягиваться к поверхности коллоидной частицы. Увеличение радиуса иона сопровождается уменьшением его гидратации и увеличивает электростататическое взаимодействие иона с поверхностью коллоидной частицы.
Ионы, относительно прочно связанные с дисперсной твердой фазой, называют потенциалопределяющими. Их заряд нейтрализуется ионами противоположного знака – противоионами. В результате на поверхности частицы формируется двойной электрический слой.
Установлено, что слой противоинов состоит из двух частей. Одна часть противоинов расположена вблизи межфазной поверхности и образует адсорбционный слой, толщина которого равна радиусу составляющих его гидратированных ионов. При этом заряд не полностью скомпенсирован и часть противоионов находится в диффузном слое (удалены от межфазной поверхности), толщина которого зависит от свойств и состава системы.
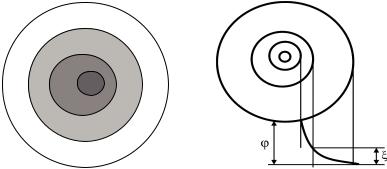
В целом коллоидная частица – мицелла – электронейтральна. Строение мицеллы и схема двойного электрического слоя
представлены на рис. 4.1.
71
IV
III
II I
а |
б |
Рис. 4.1. Строение коллоидных частиц: а – строение мицеллы: I – ядро мицеллы, II – адсорбционный слой; (I–II – гранула); III – диффузионный слой ; IV – гидратная оболочка; б – схема ДЭС
Разность потенциалов между потенциалопределяющими ионами и противоионами называется термодинамическим потенциалом двойного электрического слоя ДЭС – φ-потенциалом. В целом устойчивость коллоидных систем обусловлена наличием заряда у ядра мицеллы (коллоидная частица с потенциалоопределяющим ионом), диффузионного слоя и гидратной оболочки.
При движении частицы в дисперсионной среде или при наложении электрического поля часть противоионов диффузного слоя остается в дисперсионной среде и гранула приобретает заряд, соответствующий заряду потенциалопределяющих ионов.
Таким образом, дисперсионная среда и дисперсная фаза оказываются противоположно заряженными. Разность потенциалов между адсорбционным и диффузным слоями противоионов называется электрокинетическим ζ-потенциалом (рис. 4.1, б). Электрокинетический потенциал является одним из важнейших параметров коллоидных систем. Величина ζ-потенциала обычно составляет от 1 до 100 милливольт в зависимости от состава фаз и концентрации электролита. Чем больше величина ζ-потенциала, тем более устойчива частица.
72

Электрокинетический потенциал становится равным нулю, когда заряд гранулы мицеллы (ядро мицеллы и адсорбционный слой) компенсируется ионами – примесями в воде с образованием молекул, малорастворимых в воде. Такое состояние коллоидной системы называется изоэлектрической точкой. При этом мицеллы коллоидной системы теряют агрегативную устойчивость и выпадают в осадок.
Строение мицеллы коллоидной системы можно представить в виде формулы.
Для примера рассмотрим дисперсную систему: водный раствор – поверхность гидроксида железа (III). При избытке в растворе ионов железа (III), например при добавлении в раствор хлорида железа (III), эти ионы будут потенциалообразующими. В качестве противоионов будут выступать хлорид-ионы.
Для рассматриваемой системы можно записать формулу мицеллы в виде
Fe OH 3m nFe3 n 3x Cl 3xCl ,
где n – число потенциалообразующих ионов; x – число противоионов в диффузной части.
Следует отметить, что коллоидные растворы амфотерных гидроксидов, например гидроксидов алюминия, железа (III), могут менять заряд потенциалообразующего иона в зависимости от рН среды. Смена заряда происходит в изоэлектрической точке при рНиз. Например, при рНиз в коллоидном растворе гидроксида железа обра-
зуется Fe OH 3 3Н2О , в кислой среде преобладают ионы Fe(OH)2+,
в щелочной – [Fe(OH)4]–.
Устойчивость коллоидных систем
Устойчивость коллоидных систем определяется рядом факторов. Ю.Г. Фролов выделяет термодинамические и кинетические факторы устойчивости коллоидных дисперсных систем.
Электростатический фактор устойчивости.
Врезультате образования на поверхности коллоидных частиц адсорбционного слоя противоионов они приобретают заряд, и при сближении одноименно заряженные частицы отталкиваются под
73
действием электростатических сил. Чем выше потенциал ДЭС, тем устойчивее частицы и меньше вероятность их слипания.
Сольватационный фактор устойчивости.
Ядро мицеллы нерастворимо в воде и не гидратировано. Ионы, адсорбированные на поверхности ядра, и противоионы двойного электрического слоя гидратированы. Благодаря этому вокруг ядра создается ионно-гидратная оболочка. Толщина ее зависит от распределения ионов в адсорбционном и диффузном слоях: чем больше ионов находится в диффузном слое, тем больше и толщина гидратной оболочки. Наличие гидратных оболочек препятствует слипанию – коагуляции частиц.
Энтропийный фактор устойчивости. Мицеллы участвуют
вхаотическом тепловом движении и согласно законам термодинамики стремятся к более равномерному распределению в объеме дисперсионной среды.
Структурно-механический фактор устойчивости. На гра-
нице частица–среда возникают силы межфазного взаимодействия, обусловленные поверхностным натяжением. Чем больше силы взаимодействия частиц со средой, тем меньше вероятность их коагуляции, слипания.
Гидродинамический фактор устойчивости. На устойчи-
вость коллоидных систем оказывает влияние вязкость среды, плотность дисперсной фазы и дисперсионной среды. С увеличением вязкости раствора устойчивость коллоидных систем повышается.
Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно. Особенно высокая устойчивость наблюдается при совокупности действия термодинамических и кинетических факторов, когда наряду со снижением межфазного натяжения проявляются структурно-механические свойства межчастичных прослоек.
Седиментационная устойчивость коллоидных систем (СУ) –
способность дисперсной системы сохранять равномерное распределение частиц по всему объему, обусловленная броуновским тепло-
74
вым движением и диффузией коллоидных частиц. Седиментационная устойчивость системы зависит от действия двух факторов, направленных взаимно противоположно: силы тяжести, под действием которой частицы оседают, и диффузии, при которой частицы стремятся к равномерному распределению по объему. В результате возникает равновесное диффузионно-седиментационное распределение частиц по высоте, зависящее от их размера. Диффузия замедляется с увеличением размера частиц. Скорость оседания частиц пропорциональна квадрату их диаметра. В грубодисперсных системах скорость достижения равновесия сравнительно большая, и равновесие устанавливается в течение нескольких минут или часов. В тонкодисперсных растворах она мала, и момент равновесия может наступить через годы.
Каждому фактору устойчивости соответствует определенный метод его нейтрализации. Процесс дестабилизации коллоидных систем в результате потери агрегативной устойчивости и укрупнения частиц дисперсной фазы называют коагуляцией.
Коагуляция может быть вызвана введением в систему электролитов и воздействием физико-химических факторов (перемешивание системы, нагревание, замораживание с последующим оттаиванием, воздействие магнитного или электрического полей, ультрацентрифугирование, ультразвуковое воздействие и др.).
Например, действие электростатического фактора значительно снижается при введении в систему электролитов, которые сжимают двойной электрический слой. Сжатие диффузного слоя уменьшает степень гидратации ионов, при этом тонкие гидратные оболочки не защищает мицеллы от слипания при столкновении, в результате начинается агрегация частиц.
Сольватация при сольватационном факторе может быть снижена с помощью адсорбции на поверхности мицеллы соответствующих веществ, например поверхностно-активных веществ.
Действие гидродинамического фактора можно снизить с помощью веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц.
75
В соответствии с современными теориями дисперсных систем различают два основных механизма коагуляции:
1)концентрационную, при которой потеря устойчивости частиц связана со сжатием двойного слоя и уменьшением потенциала ДЭС – φ-потенциал;
2)нейтрализационную (коагуляция электролитами), когда на-
ряду со сжатием двойного слоя уменьшается потенциал двойного
электрического слоя φ1.
Концентрационная коагуляция характерна для сильно заря-
женных коллоидных частиц в высококонцентрированных растворах электролитов. Чем выше потенциал ДЭС, тем сильнее противоионы притягиваются к поверхности частиц и экранируют рост электрического поля. Поэтому при высоких значениях φ-потенциала силы электростатического отталкивания между частицами не возрастают безгранично, а стремятся к некоторому конечному пределу. Этот предел достигается при φболее 250 мв. Отсюда следует, что взаимодействие частиц с высоким φ-потенциалом не зависит от величины этого потенциала, а определяется только концентрацией и зарядом противоионов. По мере увеличения концентрации электролита величина ζ-потенциала частиц снижается, что приводит к их коагуляции.
Наименьшую концентрацию электролита (ммоль/л) в колло-
идном растворе, при которой начинается коагуляция, называют порогом коагуляции. Чем меньше порог коагуляции, тем меньшее количество электролита необходимо вводить в коллоидный раствор для его разрушения.
Установлено, что величина порога концентрационной коагуляции (γ) зависит от валентности противоиона, диэлектрической проницаемости раствора и может быть определена по выражению
K |
3 |
(kT )5 |
, |
(4.1) |
|
A2e6 Z 6 |
|||||
|
|
|
|||
где K – константа, слабо зависящая от отношения зарядов катиона и аниона электролита; ε – диэлектрическая проницаемость раствора; А – константа, характеризующая молекулярное притяжение частиц; е – заряд электрона; Zi – валентность противоиона.
76
Из уравнения (4.1) следует, что порог коагуляции не зависит от φ и обратно пропорционален шестой степени валентности противоионов. Для одно-, двух-, трех- и четырехвалентных ионов соотно-
шение порогов коагуляции будет равно 1: |
1 |
6 |
: |
1 |
6 |
: |
1 |
6 . |
|
2 |
|
|
3 |
|
|
4 |
|
Нейтрализационная коагуляция характерна для слабо заряженных частиц. Потеря агрегативной устойчивости обусловлена адсорбцией противоионов и снижением ζ-потенциала.
Одним из основных способов коагуляции является введение в коллоидный раствор электролитов.
Установлено, что введение одновалентных ионов в дисперсную систему приводит к относительно слабому снижению заряда частиц, в то время как двух- и трехвалентные ионы способны снизить его в несколько раз. Поэтому коагуляция многовалентными ионами проходит, как правило, по нейтрализационному механизму, а одновалентными – по концентрационному.
Можно выделить ряд эмпирических закономерностей воздействия электролитов на дисперсные системы.
Коагулирующим действием обладают ионы, заряд которых противоположен заряду потенциалообразующего иона коллоидной частицы – коагулирующие ионы, причем их коагулирующая способность выражается тем сильнее, чем выше заряд. Для коллоидных растворов (золей) с отрицательно заряженными частицами коагулирующими являются катионы, для золей с положительно заряженными частицами – анионы. Увеличение заряда или валентности иона приводит к повышению его коагулирующей способности. Если принять коагулирующую способность однозарядного иона за единицу, то коагулирующая способность двухзарядных ионов будет на порядок больше, а трехзарядных – на два порядка.
Наименьшая доза электролита, проводящая к коагуляции, является порогом коагуляции и определяется в ммоль/дм3 или мг/дм3. Порог коагуляции визуально наблюдается по началу помутнения раствора, изменению его окраски или по началу образования хлопьев и выделения их в осадок.
77

Коагулирующая способность ионов зависит от адсорбируемости ионов на поверхности гранулы и повышается с ее увеличением. В ряду неорганических ионов с одинаковым зарядом или валентностью их коагулирующая активность возрастает с уменьшением их гидратации (чем больше радиус иона, тем меньше гидратация), т.е. с увеличением радиуса иона. Сравнительную степень гидратации можно определить, используя лиотропные ряды:
Возрастание коагулирующей |
Возрастание коагулирующей |
||||||
активности |
|
|
активности |
|
|
||
Li+ |
Na+ |
K+ |
Rb+ |
Cl- |
Br- |
I- |
CNS- |
Возрастание степени гидратации |
Возрастание степени гидратации |
||||||
Некоторые органические однозарядные ионы обладают более сильным коагулирующим действием, чем двухзарядные ионы, это объясняется тем, что объемные органические ионы обладают более сильной специфической адсорбируемостью и легче входят во внутреннюю часть двойного электрического слоя. В ряду органических ионов коагулирующее действие возрастает с повышением адсорбционной способности.
Минимальная величина ζ-потенциала, при которой начинается коагуляция, составляет 30 мВ. Это критическое значение ζ-по- тенциала для большинства дисперсных систем.
На коагулирующую способность влияют не только свойства коагулирующего, но и сопутствующего иона, т. е. иона, заряженного одноименно с частицами дисперсной фазы. Это объясняют адсорбцией сопутствующих ионов на поверхности частиц, межионными
взаимодействиями или взаимодействием сопутствующих ионов с молекулами дисперсионной среды. Например, при коагуляции коллоидного раствора гидроксида алюминия Аl(ОН)3 хлоридионами с разными сопутствующими катионами выявлен следующий лиотропный ряд: NH4Cl > KCl > NaCl.
В осадках, получаемых при коагуляции электролитами, всегда присутствуют ионы, вызвавшие ее.
78
Одним из вариантов коагуляции электролитами является гетерокоагуляция – взаимная коагуляция разнородных дисперсных систем, т.е. систем, мицеллы которых имеют противоположные заряды потенциалообразущих ионов.
Гетерокоагуляция широко используется в процессах водоподготовки и очистки сточных вод и представляет собой взаимодействие коллоидных частиц с агрегатами, образующимися при введении в очищаемую воду коагулянтов – сульфата алюминия, гидроксохлоридов алюминия, алюминатнатрия, сульфатаилихлоридажелеза(II, III).
4.2. Особенности свойств растворов высокомолекулярных соединений и поверхностно-активных веществ
Растворение в воде высокомолекулярных соединений (ВМС) значительно отличается от процессов растворения неэлектролитов и электролитов, что связано с особенностями строения ВМС.
Высокомолекулярные соединения или полимеры представляют собой вещества, молекулы которых построены из многократно повторяющихся группировок атомов – структурных звеньев. Число звеньев в цепи называется степенью полимеризации – (n), исходное вещество, из которого получают полимер – мономер. В зависимости от степени полимеризации молярная масса ВМС может составлять сотни и миллионы г на 1 моль.
Большую молекулу, составленную из структурных звеньев,
называют макромолекулой или полимерной цепью. Полимеры могут иметь линейное, разветвленное или пространственное строение.
Примером природных полимеров являются белки, целлюлоза, лигнин, гумусовые вещества. Искусственные полимеры получают по реакциям полимеризации, поликонденсации и сополимеризации.
Полимеризацией называется процесс образования полимеров путем последовательного соединения мономеров, содержащих реак- ционно-способные кратные связи и циклы.
В процессе сополимеризации участвуют два или более мономеров разной химической природы и строения, например бутадиен и стирол.
79
Поликонденсацией называется процесс образования полимеров из би- или полифункциональных мономеров, сопровождающийся выделением побочных низкомолекулярных соединений (воды, спирта и т.д.).
При поликонденсации элементный состав звеньев полимера не соответствует составу исходных мономеров. Поликонденсация происходит в результате взаимодействия функциональных групп.
Примером поликонденсационного полимера является фенолформальдегидная смола, полиамидные полимеры.
Пространственное расположение атомов или групп атомов в макромолекуле относительно друг друга может меняться под действием теплового движения или внешних сил без разрушения валентных химических связей. Это явление называется конформацией макромолекул.
Взависимости от соотношения внешних сил и интенсивности теплового движения различают следующие виды конформаций макромолекул полимеров:
глобула – плотно упакованная компактная частица, близкая по форме к сфере;
статический клубок – более рыхлая, менее свернутая конформация, характерна для многих линейных полимеров (полиэтилена, полипропилена, полибутадиена и др.);
спираль, в которой конформационный порядок фиксируется чаще всего за счет водородных связей, характерна для белков, нуклеиновых кислот;
стержень или струна;
зигзаг (характерна для полиэтилена); складчатая конформация – характерна для полимеров в кри-
сталлическом состоянии.
Взависимости от внешних факторов (температуры, напряже-
ния) возможны переходы макромолекул из одной конформации в другую. Например, при растяжении полибутадиена макромолекулы изменяют конформацию статического клубка на конформацию струны.
80
