
книги / Общая и неорганическая химия. Химия и биогенные свойства элементов VA и VIA групп
.pdfСмесь одного объема HNO3 и трех объемов HCl называют «царской водкой». Это еще более сильный окислитель, чем HNO3. Окислительное действие «царской водки» обусловлено образующимся хлором:
3HCl(p) + HNO3(p) = NOCl(ж) + Cl2(г) + 2H2O(ж)
«Царская водка» растворяет золото, платину и другие неактивные металлы, переводя их в комплексные хлориды:
Au(к) + HNO3(p) + 4HCl(p) = H[AuCl4](p) + NO(г) + 2H2O(ж)
Азотную кислоту используют для получения нитропроизводных органических соединений – нитратов глицерина (нитроглицерина), толуола (тринитротолуола), целлюлозы (нитроцеллюлозы).
Соли азотной кислоты – нитраты – известны почти для всех металлов. Большинство из них бесцветны и хорошо растворимы в воде. Водные растворы нитратов при рН=7 не обладают окислительными свойствами, но их расплавы – сильные окислители, например:
расплав
MnO2(к) + KNO3(к) + 2KOH(к) = K2MnO4(к) + KNO2(к) + H2O(г)
При нагревании нитраты разлагаются с выделением кислорода. Нитраты щелочных металлов при этом переходят в соответствующие нитриты:
Т
2NaNO3(к) >400=°С 2NaNO2(к) + O2(г)
Нитраты металлов, стоящих в ряду стандартных электродных потенциалов правее меди, разлагаются с образованием металлов:
Т
2AgNO3(к) = 2Ag(к) + 2NO2(г) + O2(к)
Нитраты остальных металлов разлагаются до оксидов:
Т
2Pb(NO3)2(к) = 2PbO(к) + 4NO2(г) + O2(г)
>300°С
При нагревании NH4NO3 до температуры плавления происходит частичная возгонка соли с разложением ее пара:
31
NH4NO3(г) = NH3(г) + HNO3(г)
Расплав NH4NO3 разлагается с образованием оксида N2O:
170−200°С |
||
NH4NO3(ж) |
= |
N2O(г) + 2H2O(г) |
Расплавы нитратов щелочных металлов – сильные окислители. Они взаимодействуют с оксидами металлов (Cr2O3, MnO2), многими металлами, разрушают даже Pt.
NH3, NH4NO3, KNO3 и некоторые другие азотсодержащие соединения используют в качестве азотных удобрений. На основе аммиака производят карбамид (мочевину):
2NH3(г) + CO2(г) = CO(NH2)2(ж, к) + H2O(г)
Гидразин N2H4 используют в качестве ракетного топлива. Реакция горения гидразина сопровождается выделением большого количества энергии:
N2H4(ж) + О2(г) = N2(г) + 2Н2О(г), ∆Нº = –621 кДж/моль.
Гидразин является сильным восстановителем, и как восстановитель его используют в лабораторной практике и в производстве.
Фосфор проявляет восстановительные и окислительные свойства, причем первые для него более характерны. Он легко окисляется кислородом, галогенами, серой и др. При недостатке окислителя обычно образуются соединения фосфора (III), при избытке – соединения фосфора (V), например:
4Р(к) + 3О2(г) = 2Р2О3(к); |
4Р(к) + 5О2(г) = 2Р2О5(к); |
2Р(к) + 3F2(г) = 2PF3(к); |
2P(к) + 5F2(г) = 2PF5(к); |
2P(к) + 3S(к) = P2S3(к); |
2P(к) + 5S(к) = P2S5(к) |
Окислительная активность фосфора проявляется при взаимодействии с металлами:
Т |
Т |
3Mg(к) + 2P(к) = Mg3P2(к); |
Al(к) + P(к) = AlP(к) |
Фосфор при нагревании окисляет почти все металлы, образуя фосфиды. s-Элементы образуют фосфиды солеподобного типа: Э3Р и Э3Р2, а d-элементы – металлического типа.
32
Солеподобные фосфиды легко разлагаются водой:
Mg3P2(к) + 6H2O(к) = 3Mg(OH)2(к) + 2PH3(г)
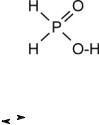
Фосфид водорода РН3 (фосфин) получают косвенным путем, так как фосфор с водородом практически не взаимодействует. Его получают при гидролизе некоторых фосфидов, а также при диспропорционировании фосфора в щелочной среде при нагревании.
Фосфин – чрезвычайно ядовитый газ с неприятным запахом, проявляет высокую реактивность. Фосфин и его производные – сильные восстановители. В отличие от NH3 фосфин не очень растворим в воде, его водные растворы нейтральны. РН3 воспламеняется на воздухе при нагревании выше 150 ºС:
РН3(г) + 2О2(г) = Н3РО4(ж, к)
Примесь Р2Н4 в РН3 сообщает фосфину склонность к самовоспламенению.
Фосфор в степени окисления +1 образует фосфорноватистую кислоту Н3РО2, которая содержит два атома водорода, непосредственно связанных с атомом фосфора:
Поэтому она является одноосновной кислотой и диссоциирует по уравнению:
Н(Н2РО2)(р) + Н2О(ж) |
|
|
|
|
|
Н3О+(р) + Н2РО2–(р), Kд = 0,08 (25 ºС). |
|
|
|
||||
|
|
|
|
|
||
|
|
|
||||
|
|
|
|
|
Н3РО2 еще называют гипофосфористой кислотой, а ее соли – гипофосфиты. Получают Н3РО2 действием Н2SO4 на гипофосфит Ba(HPO2)2. Все гипофосфиты хорошо растворимы в воде. Н3РО2 и ее соли являются сильными восстановителями. Многие металлы восстанавливаются из растворов их солей, например:
4AgNO3(р) +H(H2PO2)(р) + 2H2O(ж) = 4Ag(к) + H3PO4(р) + 4HNO3(р)
33

Если нагреть кристаллическую Н3PO2, то происходит реакция диспропорционирования:
Т
2Н3РО2(р) = Н3РО4(р) + РН3(г)
Оксид фосфора (III) Р2О3 можно получить при взаимодействии фосфора с кислородом в условиях недостатка кислорода:
4Р(к) + 3О2(г) = 2Р2О3(к, ж)
Р2О3 – твердое летучее вещество, существует в виде полимеров Р4О6. При растворении в воде образуется кислота:
Р4О6(к) + 6Н2О(ж) = 4Н2(НРО3)(р)
Фосфористая кислота Н2(НРО3) является слабой двухосновной кислотой:
Н2(НРО3)(р) + Н2О(ж) |
|
|
|
|
|
|
|
|
|
|
Н3О+(р) + Н(НРО3)– (р), |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
Kд׳ = 1 10–2 (25 ºС); |
|||||||||||
Н2(НРО3)–(р) + Н2О(ж) |
|
|
|
|
|
|
|
|
|
Н3О+(р) + НРО32– (р), |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
Kд׳׳ = 3 10–7 (25 ºС)
В молекуле фосфористой кислоты один атом водорода связан непосредственно с атомом фосфора:
Фосфористую кислоту обычно получают гидролизом PCl3 или взаимодействием Р2О3 с водой:
PCl3(к) + 3H2O(ж) = H2HPO3(р) + 3HCl(р)
Фосфористая кислота обладает как окислительными, так и восстановительнымисвойствами, способнатакже диспропорционировать:
Н3РO3(р) + 2AgNO3(р) + H2O(ж) = H3PO4(р) + 2Ag(к) + 2HNO3(р);
34
H3PO3(р) + 3Zn(к) + 3H2SO4(р) = 3ZnSO4(р) + PH3(г) + 3H2O(ж);
4H3PO3(р) = 3H3PO4(р) + PH3(г)
Важнейшим галогенидом фосфора (III) является хлорид фосфора PCl3. Он хорошо поглощает воду из воздуха, при растворении в воде образует две кислоты: кислородсодержащую Н3РО3 и бескислородную HCl. Такие соединения называют галоидоангидридами. В ряду галогенидов PF3 – PCl3 – PBr3 – PI3 устойчивость молекул падает.
Сульфиды фосфора (III) бывают различного состава (P2S3, P4S3, P4S10 и т.д.). Сульфид фосфора P2S3 по структуре аналогичен оксиду P2O3. Сульфиды фосфора (III) – желтые кристаллические, легко воспламеняющиеся вещества, гидролизуются необратимо.
Оксид фосфора (V) – наиболее стабильный оксид фосфора, твердое летучее вещество, существующее в виде полимера. Р2О5 получают при сжигании фосфора на воздухе или в кислороде. Полученный продукт имеет вид белой снегообразной массы, обычно состоящей из смеси разных форм Р2О5. Оксид Р2О5 очень активно поглощает воду. Его используют при осушении газов и жидкостей.
Фосфор в степени окисления +5 образует много кислот. Наиболее известной является ортофосфорная кислота Н3РО4, ее получают по реакциям:
Т
P2O5(к) + 3H2O(ж) = 2H3PO4(р);
Ca3(PO4)2(к) + 3H2SO4(р) = 2H3PO4(р) + 3CaSO4(к)
Эта трехосновная кислота средней силы диссоциирует по трем ступеням.
В отличие от HNO3 фосфорная кислота не обладает окислительными свойствами.
При взаимодействии Р2О5 с водой без нагревания образуется метафосфорная кислота НРО3. Обезвоживание Н3РО4 при 200– 250 ºС приводит к образованию дифосфорной кислоты Н4Р2О7. В свободном состоянии она представляет собой твердое вещество. Это более сильная кислота, чем Н3РО4 (Kд = 3·10–2).
Ионы РО43– обладают способностью образовывать посредством кислородных мостиков полимерные ионы. Кислоты такого типа
35
с открытой цепью называют полифосфорными с обшей формулой Нn+2PnO3n+1 и метафосфорными с общей формулой (НРО3)n.
Например:
Н4Р2О7 – диполифосфорная (пирофосфорная кислота), Н5Р3О10 – триполифосфорная кислота, Н6Р4О13 – тетраполифосфорная кислота, Р3О93– – ион триметафосфата.
При увеличении температуры возможны превращения:
Н3РО4 220°С→ Н4Р2О7 320°С→ (НРО3)n.
Соли фосфорной кислоты – фосфаты и гидрофосфаты – бесцветные вещества.
Дигидрофосфаты (NaH2PO4 и др.) растворимы в воде. Все остальные соли фосфорной кислоты, кроме фосфатов щелочных металлов и аммония, нерастворимы в воде.
Растворимые в воде фосфаты подвергаются гидролизу:
Na3PO4(к) + H2O(ж) |
|
|
|
|
|
Na2HРO4(р) + NaOH(р) (I ступень). |
|
|
|
||||
|
|
|
|
|
||
|
|
|
||||
|
|
|
|
|
Средние фосфаты при гидролизе дают щелочную среду (рН > 7), гидрофосфаты – слабощелочную (рН > 7), дигидрофосфаты – кислую
(pH < 7).
Большое количество соединений фосфора идет на производство удобрений. В качестве удобрений наиболее широко используют суперфосфат – смесь CaSO4 5H2O и Ca(H2PO4)2, двойной суперфосфат – Са(Н2РО4)2, аммофос – смесь NH4H2PO4 и (NH4)2HPO4.
Фосфаты или полифосфаты щелочных металлов входят в состав моющих средств. Полифосфаты используют для устранения жесткости воды (с ионами Mg2+ и Са2+ образуются хелатные комплексы) и как ингибиторы коррозии. Другие области применения соединений фосфора – пищевая промышленность, химическая, электрохимическая (нанесение металлических покрытий), водоподготовка и др.
36
2.4. Свойства мышьяка, сурьмы, висмута и их соединений
При переходе от фосфора к мышьяку, сурьме и висмуту усиливается тенденция к образованию соединений с серой и серосодержащими лигандами. В природе As, Sb и Bi, как правило, встречаются в виде сульфидов: As2S3, Sb2S3 и Bi2S3.
Чистые мышьяк, сурьма, висмут в металлической модификации по отношению к кислороду воздуха ведут себя по-разному. Сурьма и висмут в сухом воздухе практически не окисляются, а мышьяк образует с кислородом воздуха As2О3, который не пассивирует поверхность мышьяка, и мышьяк может окисляться полностью.
При нагревании на воздухе As, Sb и Bi сгорают до Э2О3:
Т
4Э(к) + 3О2(г) = 2Э2О3(к).
As и Sb непосредственно взаимодействуют с галогенами, а Bi реагирует при нагревании:
2As(к) 2Sb(к)
2Bi(к)
+3Cl2(г) = 2AsCl3(к);
+5Cl2(г) = 2SbCl5(к);
Т
+ 3Cl2(г) = 2BiCl3(к)
При нагревании As, Sb и Bi реагируют с серой, образуя сульфиды, например:
Т
2As(к) + 3S(к) = As2S3(к)
С водородом они непосредственно не взаимодействуют.
As, Sb и Bi имеют положительное значение величины стандартного электродного потенциала и поэтому не взаимодействуют с кислотами, не являющимися окислителями. Взаимодействие с ки- слотами-окислителями протекает по-разному, например:
2Bi(к) + 6H2SO4(конц.) = Bi2(SO4)3(р) + 3SO2(г) + 6H2O(ж);
As(к) + 5HNO3(конц.) = H3AsO4(р) + 5NO2(г) + H2O(ж);
Sb(к) + 5HNO3(разб.) = HSbO3(р) + 5NO2(г) + 2H2O(ж)
37
Соединения мышьяка, сурьмы и висмута с металлами малохарактерны. Солеподобные соединения получены только для s-элементов. Ихназывают арсенидами (K3As), стибидами (Ca3Sb2), висмутидами (Mg3Bi2). Вбольшинстве случаев As, Sb и Bi при взаимодействии сметаллами образуютсоединения металлического типа.
Поскольку с водородом As, Sb и Bi непосредственно не взаимодействуют, то гидриды получают косвенным путем:
Mg3As2(к) + 6HCl(р) = 3MgCl2(р) + 2AsH3(г);
Mg3Sb2(к) + 6HCl(р) = 3MgCl2(р) + 2SbH3(г)
Гидриды арсин AsН3, стибин SbH3 и висмутин BiH3 – это газообразные вещества с резким запахом, очень токсичны. Ослабление неметаллических свойств в ряду N – P – As – Sb – Bi проявляется в их соединениях с водородом. При переходе от азота к висмуту полярность и электронно-донорные свойства в соединениях ЭН3 уменьшаются, а восстановительные – усиливаются.
Устойчивость соединений с водородом в этом ряду падает. Они являются сильнейшими восстановителями.
Степень окисления +3 мышьяк и его аналоги проявляют в оксидах Э2О3, галогенидах ЭГ3, сульфидах Э2S3 и их производных.
Кислотные свойства оксидов в ряду As – Sb – Bi уменьшаются, т.е. у As2O3 преобладают кислотные свойства, у Sb2O3 – амфотерные, аBi2O3 обладает отчетливовыраженными основными свойствами.
Оксиды Э2О3 – твердые вещества. В воде растворим только
As2O3.
As2O3 и Sb2O3 взаимодействуют со щелочами: As2O3(к) + 2KOH(р) + 3H2O(ж) = 2K[As(OH)4](р); Sb2O3(к) + 2KOH(р) + 3H2O(ж) = 2K[Sb(OH)4](р)
Bi2O3 со щелочами практически не взаимодействует, но легко взаимодействует с кислотами:
Bi2O3(к) + 6HNO3(р) = 2Bi(NO3)3(р) + 3H2O(ж)
Мышьяк, сурьма и висмут образуют гидроксиды Э(ОН)3. Это амфотерные соединения. У As(OH)3 преобладают кислотные
38
свойства, а у Bi(OH)3 – основные, Sb(OH)3 и Bi(OH)3 нерастворимы в воде. As(OH)3 может быть получен взаимодействием As2O3 с H2O. В водном растворе ведет себя как слабая кислота H3AsO3 (ортомышьяковистая). В водных растворах она находится в равновесии с метамышьяковистой кислотой HAsO2:
H3AsO3(р) |
|
|
|
|
|
HAsO2(р) + H2O(ж). |
|
|
|
||||
|
|
|
|
|
||
|
|
|
||||
|
|
|
|
|
Нерастворимые в воде Sb(OH)3 и Bi(OH)3 получают действием растворов щелочей на соответствующие соли:
SbCl3(р) + 3NaOH(р) = Sb(OH)3(к) + 3NaCl(р);
Bi(NO3)3(р) + 3NaOH(р) = Bi(OH)3(к) + 3NaNO3(р)
Для обоих соединений характерны продукты обезвоживания – SbOOH и BiOOH. Соли мышьяковистой кислоты называются арсенитами. Их получают при действии щелочей на As2O3:
As2O3(р) + 6KOH(р) = 2K3AsO3(р) + 3H2O(ж)
Важной солью Bi(III) является Bi(NO3)3. Соли сурьмы и висмута легко гидролизуются с образованием малорастворимых основных солей, которые, в свою очередь, обезвоживаются, переходя в нерастворимые оксогалогениды, например:
SbCl3(р) + 2H2O(ж) = Sb(OH)2Cl(к, р) + 2HCl(р);
Sb(OH)2Cl(к) = (SbO)Cl(к) + H2O(ж);
Bi(NO3)3(р) + 2H2O(ж) = Bi(OH)2NO3(к, р) + 2HNO3(р);
Bi(OH)2NO3(к, р) = BiONO3(к) + H2O(ж)
Галогениды мышьяка похожи на галогениды фосфора. Сульфиды As2S3, Sb2S3 и Bi2S3 окрашены, нерастворимы в воде.
Сульфиды As(III) и Sb(III) легко растворяются в щелочах и сульфиде аммония с образованием тиосолей (тиоантимонита аммония (NH4)3SbS3 и тиоарсенита аммония (NH4)3AsS3):
Sb2S3 + 3(NH4)2S = 2(NH4)3SbS3
В тиосолях кислород заменен на серу.
39
Bi2O3 с сульфидами практически не взаимодействует.
Оксиды As(V), Sb(V) и Bi(V) при обычных условиях твердые вещества. Устойчивость этих оксидов уменьшается при переходе от мышьяка к висмуту. As2O5 и Sb2O5 получают обезвоживанием соответствующих гидроксидов. As2O5 хорошо растворяется в воде с образованием ортомышьяковой кислоты H3AsO4:
As2O5(к) + 3H2O(ж) = 2H3AsO4(р)
Эта кислота средней силы ( Kд׳ = 6 10–3, Kд׳׳ = 2 10–7, Kд׳׳׳ =
= 3 10–12) – аналог ортофосфорной кислоты. Sb2O5 в воде растворим плохо, лучше растворяется в щелочных растворах:
Sb2O5(к) + 2KOH(р) + 5H2O(ж) = 2K[Sb(OH)6](р)
При попытке получения сурьмяных кислот образуется осадок
хSb2O5 yH2O.
В свободном состоянии не выделены и кислородные кислоты
Bi(V).
Соли мышьяковой кислоты H3AsO4 и сурьмяной кислоты (хSb2O5 yH2O) – арсенаты и стибаты (антимонаты) – вследствие сходства строения электронных оболочек атомов Р и As, Sb похожи на ортофосфаты, например Na3AsO4, Ca3(AsO4)2, гидроарсенаты
Na2HAsO4, CaHAsO4 и дигидроарсенаты NaH2AsO4, Ca(HAsO4)2.
При действии сильных окислителей на производные Bi(III) можно получить производные Bi(V):
BiCl3(р) + Br2(ж) + 6KOH(р) = KBiO3(к) + 3KCl(р) + 2KBr(р) + 3H2O(ж)
Подобно фосфатам, арсенаты, стибаты и висмутаты, как правило, труднорастворимы в воде.
Мышьяк, сурьма и висмут, взаимодействуя непосредственно с галогенами, образуют галогениды ЭГ5. Все галогениды мышьяка похожи на галогениды фосфора. Галогениды Sb(V) и Bi(V) имеют типично кислотный характер.
Сульфиды этих элементов As2S5, Sb2S5, Bi2S5 могут быть получены косвенным путем. Их устойчивость резко падает в ряду As2S5 – Sb2S5 – Bi2S5. Пентасульфиды мышьяка и сурьмы также ти-
40
