
книги / Физическая химия. Основы химической термодинамики и химическое равновесие
.pdf
вается. Пипетку перед отбором пробы споласкивают исследуемым раствором.
4.Через 30 мин после отбора пробы из каждой колбы берут сно-
ва 10 см3 раствора и титруют раствором Na2S2O3. Затем через 40 мин отбирают третью пробу и т.д. Одинаковое число см3 раствора
Na2S2O3, израсходованное на титрование йода в двух последовательно взятых из каждой колбы пробах, указывает на достижение равновесия в реакции.
5.В такой же последовательности проводят опыт при другой
температуре (например, при 40 °С). Расчет KC производят отдельно для двух взятых растворов при двух температурах. Экспериментальные и расчетные данные заносят в табл. 6.2 и 6.3.
6.Аналогичные таблицы заполняют для опытов, проведенных при другой температуре термостата, рассчитывают другие термодинамические характеристики реакции. Делают вывод о достижении равновесия и факторах, влияющих на величину KC.
|
|
Экспериментальные данные |
Таблица 6.2 |
|||
|
|
|
||||
|
Опыт 1 |
|
Опыт 2 |
|
||
|
|
|
|
|
|
|
№ |
время |
|
V1 – объем |
№ |
время |
V1 – объем |
пробы |
отбора |
|
раствора |
пробы |
отбора |
раствора |
|
пробы |
|
Na2S2O3, |
|
пробы |
Na2S2O3, |
|
|
|
см3 |
|
|
см3 |
|
|
|
|
|
|
|
|
|
|
Расчетные данные |
|
Таблица 6.3 |
|
|
|
|
|
|
||
|
|
Данные |
|
Номер опыта |
||
Объем раствора FeCl3, взятого для опыта, а, см3
Объем раствора KI, взятого для опыта, b, см3
Объем раствора Na2S2O3, пошедший на титрование, V1 , cм3
Объем пробы, отобранный для титрования, V2, см3
31

|
Окончание табл. 6.3 |
Данные |
Номер опыта |
Равновесная концентрация I2, CI 2 , моль/л
РавновеснаяконцентрацияионовFe2+ , CFe 2+ , моль/л
ИсходнаяконцентрацияраствораFeCl3, C FeCl 3 , моль/л
РавновеснаяконцентрацияионовFe3+ , CFe+2 , моль/л
Исходная концентрация раствора KI, СKI , моль/л
Равновесная концентрация ионов I– , CI − , моль/л
Константа равновесия, KC
Лабораторная работа № 7.
Изучение химического равновесия в гетерогенной системе
Цель работы
Освоить статический метод исследования химического равновесия; изучить зависимость химического равновесия от температуры; по экспериментальным данным рассчитать тепловой эффект и другие термодинамические характеристики реакции.
Вопросы коллоквиума
1.Химическое равновесие. Условие химического равновесия. Константа равновесия.
2.Закон действующих масс. Термодинамический вывод константы равновесия.
3.Подвижность химического равновесия. Принцип Ле-Шателье. Влияние изменения внешних условий на равновесие.
4.Уравнение изобары химической реакции как количественное выражение смещения равновесия при изменении температуры. Анализ и интегрирование уравнения изобары.
5.Определение теплового эффекта реакции по константам равновесия при различных температурах.
6.Экспериментальные методы определения упругости диссоциации.
32
Приборы и реактивы
1.Печь трубчатая.
2.Манометр.
3.Милливольтметр.
4.Карбонат кальция.
Методика выполнения работы и ее обоснование
Химическое равновесие в гетерогенных системах рассмотрим на примере реакции диссоциации карбоната кальция.
Процессы диссоциации карбонатов широко распространены в металлургии и химической промышленности (обжиг известняка, разложение известняка в доменной печи, где он используется в качестве флюса, известковое кипение в мартеновской печи и т.д.).
Карбонат кальция, являющийся составной частью мела, известняка, мрамора, диссоциирует по реакции:
CaCO3(т) = CaO(т) + CO2(г).
Эта реакции обратима. Константа равновесия имеет вид
Ka |
= |
aCaO aCO2 |
= |
aCaO fCO2 |
, |
(7.1) |
aCaCO3 |
|
|||||
|
|
|
aCaCO3 |
|
||
где aCaO , aCaCO3 – активности оксида и карбоната кальция; fCO2 – фугитивность двуокиси углерода.
Считаем, что активности чистых фаз CaCO3(т) и CaO(т) при данной
температуре постоянны: aCaO = 1 и aCaCO3 |
= 1, и при небольших давле- |
ниях fCO2 = PCO 2 . Константа равновесия реакции принимает вид |
|
KP = PCO2 , |
(7.2) |
где PCO2 – равновесное давление или упругость диссоциации карбоната кальция.
33
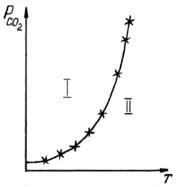
Изменение упругости диссоциации с ростом температуры можно показать на основании уравнения изобары реакции:
d ln KP |
= |
∆ H |
. |
(7.3) |
|
|
|||
dT |
RT 2 |
|
||
С учетом (7.2) уравнение изобары для данной реакции можно записать:
d ln PCO2 |
= |
∆ H |
. |
(7.4) |
|
dT |
RT 2 |
||||
|
|
|
Для процесса диссоциации ∆H > 0, поэтому упругость диссоциации растет с увеличением температуры.
Изменение упругости диссоциации с ростом температуры показано на рис. 2. Кривая делит плоскость диаграммы на две области. В области, лежащей выше равновесной кривой, устойчив карбонат кальция, ниже – оксид кальция. Для области I характерны давления CO2, большие, чем равновесные.
Используя уравнение изотермы:
∆ G= RT (ln PCO2 (факт)− ln PCO2 ( теор) ) , |
(7.5) |
можно определить знак ∆G для процесса в условиях I. Так как фактическое давление CO2 для всех точек этой области выше равновесного,
т.е. PCO2 (факт) > PCO2 ( теор) , то ∆G > 0.
Рис. 2. Зависимость упругости диссоциации от температуры
Следовательно, в условиях повышенного по сравнению с равновесным, давления CO2, возможна обратная реакция – процесс карбонизации:
CaO(т) + CO2(г) = CaCO3(т).
Аналогично рассуждая для об- ласти II, где PCO2 (факт) < PCO2 ( теор) ,
можно заключить, что при давлениях ниже равновесного возможно развитие процесса диссоциации, так как ∆G < 0.
34
Численные значения равновесных PCO2 (атм) при различных температурах могут быть получены из уравнения:
|
|
|
|
∆ HT0 |
∆ |
ST0 |
|
|||
|
ln PCO |
|
= − |
|
|
+ |
|
|
, |
(7.6) |
|
|
RT |
|
|
||||||
|
|
2 |
|
|
|
R |
|
|||
|
|
|
|
|
|
|
|
|
|
|
где ∆ HT0 – тепловой эффект реакциипри данной температуре, Дж/моль; |
||||||||||
∆ ST0 – изменение |
энтропии реакции |
для этой |
же температуры, |
|||||||
Дж/(моль·К). |
|
|
|
|
|
|
|
|
|
|
Теоретические значения ∆ HT0 и ∆ ST0 можно рассчитать, исполь- |
||||||||||
зуя справочные величины (табл. 7.2). |
|
|
|
|
|
|||||
Проинтегрировав |
уравнение (7.4) |
в |
пределах |
PCO2 (1) и PCO2 ( 2) |
||||||
и соответственно T1 и T2 (предполагая постоянство ∆H в данном интервале температур), получим соотношение:
ln PCO ( 2) |
= ln PCO (1) |
+ |
∆ H |
( |
1 |
− |
1 |
) , |
(7.7) |
|
|
|
|||||||
2 |
2 |
|
R T1 T2 |
|
|||||
|
|
|
|
|
|
|
|
||
из которого можно найти величину теплового эффекта реакции в данном температурном интервале:
∆ H= |
R(ln PCO2 ( 2) − ln PCO2 |
(1) ) |
. |
(7.8) |
||||
|
1 |
− |
1 |
|
|
|||
|
|
|
|
|
||||
|
|
T1 |
T2 |
|
|
|
||
|
|
|
|
|
|
|||
Для измерения упругости диссоциации карбонатов часто используют статический метод. Суть его заключается в непосредственном измерении давления в установке, предварительно откачанной до предельного разряжения. При этом в печи при заданной температуре помещена навеска карбоната кальция. При малых равновесных давлениях PCO2 измеряют с помощью манометра Мак-
Леода, принцип действия которого основан на законе PV = const. При больших упругостях диссоциации иногда ограничиваются масляным U-образным манометром (рис. 3).
Порядок выполнения работы
1. Через открытый конец кварцевой трубки (см. рис. 3) в печь помещаютнавескукарбонатакальция, вескоторойстрогонеконтролируется,
35
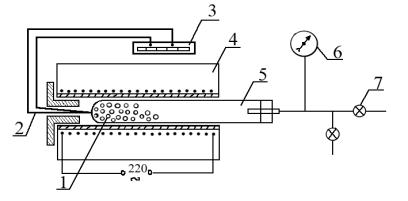
Рис. 3. Схема установки: 1 – образец; 2 – термопара; 3 – милливольтметр; 4 – печь; 5 – кварцевая трубка; 6 – вакуумметр; 7 – двухходовой кран
однако должен быть избыток карбоната по сравнению с количеством, необходимым для установления равновесия. Иногда навеска бывает заранее внесена в трубку печи. Конец трубки закрывается шлифом или пробкой и включается масляный ротационный насос. Вакуумный кран при этом открыт, а кран для впуска воздуха закрыт. Если опыт производится с навеской повторно (перед началом опыта в установке разряжение), то вакуумный кран открывают на 2–3 мин после включения насоса, когда в части системы создается разряжение. Открывать вакуумный кран следует очень осторожно, поддерживая его левой рукой, а правой плавно поворачивая пробку крана. Система откачивается до предельного разряжения. Закрывают вакуумный кран, включают насос и открывают кран для впуска воздуха. При использовании только трехходового крана впуск воздуха и подсоединение вакуума производятся с его помощью. Указанные действия выполняются
вприсутствии преподавателя.
2.Систему выдерживают под вакуумом, проверяя ее надежность
втечение 5–10 мин. Затем включают печь и доводят температуру до первой заданной. Поддерживая температуру постоянной в течение 10–15 мин, достигают установления постоянного давления, определяемого манометром. Показание манометра при данной температуре позволяет рассчитать упругостью диссоциации известняка. При вы-
36

соких температурах выдержку можно делать меньше, чем при низких, так как скорость реакции с ростом температуры возрастает. При достижении постоянного давления записывают его величину и повышают температуру печи до следующей заданной. Таким образом, производят измерения разновесных давлений CO2 при нескольких температурах в диапазоне 500–800 °С с шагом в 25–50 °С (по заданию преподавателя).
3. По опытным данным строят график в координатах ln PCO |
|
– |
1 |
, |
|
|
|||
|
2 |
|
T |
|
|
|
|
|
|
из которого определяют тепловой эффект реакции по уравнению 7.8. 4. Теоретические значенияPCO2 рассчитывают по уравнению 7.6. Вели-
чины ∆ HT0 и ∆ ST0 находятспомощьюсправочныхданных(см. табл. 7.2).
5.Сопоставляют теоретические и опытные значения PCO2 и ∆ HT0
иделают вывод о влиянии температуры на химическое равновесие.
|
|
|
|
|
|
Опытные и теоретические данные |
|
|
Таблица 7.1 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
Опытные данные |
|
|
|
|
|
|
|
Теоретические данные |
||||||||||||||||||
|
темпе- |
|
показания |
|
ln P |
|
1 |
|
|
∆ H 0 , |
|
|
∆ S 0 , |
|
ln P |
|
PCO2 |
||||||||||||
|
ратура, |
|
|
|
, |
|
T |
|
|
|
T |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
вакууметра |
|
|
CO2 |
|
|
|
|
Дж |
|
|
|
Дж |
|
|
CO2 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
T |
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
моль |
|
|
моль К |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
K–1 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
°С |
K |
|
n |
PCO2 , Па |
|
|
|
|
|
|
|
|
|
|
|
атм |
Па |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Справочные термодинамические данные |
|
Таблица 7.2 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
∆ H 0f ,298 , |
|
|
S2980 , |
|
|
|
|
|
Коэффициенты уравнения |
|
||||||||||||||
|
Вещество |
|
|
кДж |
|
|
Дж |
|
|
|
|
|
|
|
|
|
|
С0P = f (T) |
|
|
|
|
|
||||||
|
|
|
|
|
|
моль |
|
|
моль К |
|
|
|
|
|
а |
|
|
|
b 103 |
|
|
c' 10–5 |
|
||||||
|
СаСО3 (т) |
|
–1206,83 |
|
91,71 |
|
|
|
|
104,52 |
|
|
|
21,92 |
|
|
–25,94 |
|
|||||||||||
|
СаО (т) |
|
|
|
–635,10 |
|
38,07 |
|
|
|
|
49,63 |
|
|
|
4,52 |
|
|
|
–6,95 |
|
||||||||
|
СО2 (г) |
|
|
|
–393,51 |
|
213,66 |
|
|
|
|
44,14 |
|
|
|
9,04 |
|
|
|
–8,53 |
|
||||||||
37
ПРИЛОЖЕНИЕ 1
Интегральные теплоты растворения солей в воде при 25 °С
При m = 0,00 даны значения ∆ Hm, экстраполированные к бесконечному разбавлению.
m, |
|
|
|
∆ Hm, кДж/моль |
|
|
|
|
моли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
солина |
LiCl |
LiBr |
NaCl |
NaBr |
NaI |
KBr |
KI |
KCl |
1 кгH2O |
|
|
|
|
|
|
|
|
0,00 |
–37,13 |
–49,02 |
3,89 |
–0,63 |
–7,57 |
20,04 |
20,50 |
17,23 |
0,01 |
–36,97 |
–48,91 |
4,06 |
–0,50 |
–7,41 |
20,17 |
20,67 |
17,39 |
0,02 |
–36,86 |
–48,87 |
4,10 |
–0,42 |
–7,36 |
20,25 |
20,71 |
17,44 |
0,05 |
–36,71 |
–48,74 |
4,18 |
–0,31 |
–7,24 |
20,29 |
20,73 |
17,51 |
0,1 |
–36,48 |
–48,62 |
4,25 |
–0,29 |
–7,20 |
20,33 |
20,71 |
17,55 |
0,2 |
–36,34 |
–48,39 |
4,27 |
–0,27 |
–7,15 |
20,29 |
20,67 |
17,57 |
0,3 |
–36,19 |
–48,28 |
4,25 |
–0,29 |
–7,24 |
20,25 |
20,59 |
17,55 |
0,4 |
–36,07 |
–48,20 |
4,16 |
–0,40 |
–7,32 |
20,15 |
20,42 |
17,50 |
0,5 |
–35,98 |
–48,12 |
4,10 |
–0,44 |
–7,41 |
20,04 |
20,29 |
17,43 |
1,0 |
–35,65 |
–47,74 |
3,79 |
–0,86 |
–7,82 |
19,54 |
19,73 |
17,28 |
2,0 |
–35,15 |
–47,11 |
3,18 |
–1,65 |
–8,62 |
18,68 |
18,62 |
16,72 |
3,0 |
–34,52 |
–46,53 |
2,66 |
–2,28 |
–9,37 |
17,99 |
17,66 |
16,17 |
4,0 |
–33,89 |
–46,02 |
2,26 |
–2,78 |
–10,04 |
17,36 |
16,82 |
15,75 |
5,0 |
–33,18 |
–45,50 |
1,99 |
–3,20 |
–10,54 |
16,82 |
16,09 |
– |
6,0 |
–32,43 |
–44,85 |
1,88 |
–3,47 |
–10,92 |
– |
15,47 |
– |
7,0 |
–31,63 |
–44,23 |
– |
–3,66 |
–11,13 |
– |
14,92 |
– |
8,0 |
–30,79 |
–43,51 |
– |
–3,70 |
–11,25 |
– |
14,46 |
– |
9,0 |
–29,92 |
–42,80 |
– |
–3,62 |
–11,25 |
– |
– |
– |
10,0 |
–29,00 |
–41,97 |
– |
– |
–11,17 |
– |
– |
– |
Насыщ. |
–19,35 |
–31,88 |
1,95 |
–3,61 |
–10,59 |
16,49 |
14,07 |
15,45 |
раствор |
|
|
|
|
|
|
|
|
mнасыщ |
19,90 |
18,60 |
6,15 |
9,15 |
12,33 |
5,70 |
8,98 |
4,82 |
38
m, |
|
|
|
∆ Hm, кДж/моль |
|
|
|
||
моли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
соли на |
NH4Cl |
NH4NO3 |
CaCl2 |
K2SO4 |
CuSO4 |
MgSO4 |
ZnSO4 |
MnSO4 |
|
1 кг |
|||||||||
|
|
|
|
|
|
|
|
||
H2O |
|
|
|
|
|
|
|
|
|
0,00 |
14,73 |
25,77 |
–82,93 |
23,71 |
–73,14 |
–91,63 |
–83,26 |
–64,39 |
|
0,01 |
14,85 |
25,77 |
–82,68 |
24,48 |
–69,87 |
–89,37 |
–80,67 |
–60,71 |
|
0,02 |
14,94 |
25,79 |
–82,38 |
24,58 |
–69,33 |
–89,04 |
–80,29 |
–60,12 |
|
0,05 |
15,02 |
25,82 |
–81,25 |
24,75 |
–68,70 |
–88,45 |
–79,70 |
–59,29 |
|
0,1 |
15,10 |
25,75 |
–80,88 |
24,78 |
–68,07 |
–87,91 |
–79,16 |
–58,70 |
|
0,2 |
15,19 |
25,56 |
–80,50 |
24,58 |
–67,57 |
–87,26 |
–78,78 |
–57,95 |
|
0,3 |
15,23 |
25,38 |
–80,25 |
24,27 |
–67,32 |
–86,92 |
–78,58 |
–57,53 |
|
0,4 |
15,27 |
25,21 |
–80,02 |
23,95 |
–67,15 |
–86,67 |
–78,41 |
–57,24 |
|
0,5 |
15,27 |
25,06 |
–79,83 |
23,58 |
–67,03 |
–86,48 |
–78,28 |
–57,07 |
|
1,0 |
15,31 |
24,31 |
–79,04 |
– |
–66,65 |
–85,77 |
–77,91 |
–56,65 |
|
2,0 |
15,27 |
23,05 |
–77,74 |
– |
– |
–84,87 |
–77,03 |
–55,56 |
|
3,0 |
15,23 |
21,97 |
– |
– |
– |
– |
–75,44 |
– |
|
4,0 |
15,19 |
21,17 |
– |
– |
– |
– |
– |
– |
|
5,0 |
15,15 |
20,46 |
– |
– |
– |
– |
– |
– |
|
6,0 |
15,10 |
19,92 |
– |
– |
– |
– |
– |
– |
|
7,0 |
15,02 |
19,41 |
– |
– |
– |
– |
– |
– |
|
8,0 |
– |
18,95 |
– |
– |
– |
– |
– |
– |
|
9,0 |
– |
18,54 |
– |
– |
– |
– |
– |
– |
|
10,0 |
– |
18,16 |
– |
– |
– |
– |
– |
– |
|
Насыщ. |
15,02 |
– |
– |
22,78 |
– |
– |
– |
– |
|
раствор |
|
|
|
|
|
|
|
|
|
mнасыщ |
7,35 |
– |
– |
0,69 |
– |
– |
– |
– |
|
39
ПРИЛОЖЕНИЕ 2
Интегральные теплоты растворения кислот и оснований в воде при 25 °С
|
моли,mкислощелочиилиты кгнаH1 |
|
|
|
–∆ Hm, кДж/моль |
|
|
|||
мЧислоолей H кислоты щелочи |
HCOOH |
HCl |
HNO |
|
H |
H |
NH |
NaOH |
KOH |
|
моль 1 или |
2 |
|
|
|
|
|
|
|
|
|
наO |
O |
|
|
|
|
SO |
PO |
|
|
|
|
|
|
3 |
|
3 |
|
|
|||
|
|
|
|
|
|
4 |
4 |
|
|
|
2 |
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
55,51 |
0,83 |
26,23 |
13,11 |
|
28,07 |
–4,52 |
29,54 |
– |
– |
2 |
27,75 |
0,87 |
48,82 |
20,08 |
|
41,92 |
–0,50 |
32,05 |
– |
– |
3 |
18,50 |
0,79 |
56,85 |
24,30 |
|
48,99 |
1,88 |
32,76 |
28,89 |
41,80 |
4 |
13,88 |
0,71 |
61,20 |
26,98 |
|
54,06 |
3,47 |
33,26 |
34,43 |
45,77 |
5 |
11,10 |
0,67 |
64,05 |
28,73 |
|
58,03 |
4,52 |
33,60 |
37,76 |
48,24 |
6 |
9,25 |
0,62 |
65,89 |
29,84 |
|
60,75 |
5,36 |
– |
39,87 |
49,87 |
8 |
6,94 |
0,58 |
68,23 |
31,12 |
|
64,60 |
6,40 |
– |
41,92 |
51,76 |
10 |
5,55 |
0,56 |
69,49 |
31,84 |
|
67,03 |
7,11 |
34,27 |
42,51 |
52,66 |
15 |
3,70 |
0,55 |
70,99 |
32,46 |
|
70,17 |
8,08 |
– |
42,84 |
53,62 |
20 |
2,78 |
0,55 |
71,78 |
32,67 |
|
71,50 |
8,58 |
34,43 |
42,87 |
53,95 |
30 |
1,85 |
0,56 |
72,59 |
32,76 |
|
72,68 |
9,12 |
34,48 |
– |
– |
40 |
1,39 |
0,57 |
73,02 |
32,75 |
|
73,09 |
– |
34,48 |
– |
– |
50 |
1,11 |
0,60 |
73,28 |
32,74 |
|
73,35 |
9,58 |
34,52 |
42,53 |
54,33 |
75 |
0,740 |
0,65 |
73,65 |
32,74 |
|
73,68 |
9,87 |
– |
– |
– |
100 |
0,555 |
0,66 |
73,85 |
32,75 |
|
73,97 |
10,04 |
34,56 |
42,34 |
54,45 |
200 |
0,278 |
– |
74,20 |
32,80 |
|
74,94 |
10,42 |
34,64 |
42,30 |
54,56 |
500 |
0,111 |
– |
74,52 |
32,90 |
|
76,73 |
10,71 |
– |
42,36 |
54,75 |
700 |
0,0793 |
– |
74,61 |
32,94 |
|
77,57 |
10,79 |
– |
– |
– |
1000 |
0,0555 |
– |
74,68 |
32,98 |
|
78,58 |
10,84 |
– |
42,47 |
54,87 |
2000 |
0,0278 |
– |
74,82 |
33,05 |
|
80,88 |
10,96 |
– |
42,55 |
55,00 |
5000 |
0,0111 |
– |
74,93 |
33,13 |
|
84,43 |
11,05 |
– |
42,66 |
55,10 |
10000 |
0,0056 |
– |
74,99 |
33,19 |
|
87,07 |
11,09 |
– |
42,72 |
55,17 |
20000 |
0,0028 |
– |
75,04 |
– |
|
89,62 |
11,13 |
– |
– |
– |
50000 |
0,0011 |
– |
75,08 |
33,27 |
|
92,34 |
11,17 |
– |
42,80 |
55,25 |
∞ |
0,0000 |
0,71 |
75,14 |
33,34 |
|
96,19 |
(13,4) |
34,64 |
42,87 |
55,31 |
|
|
|
|
|
|
|
|
|
|
|
40
