
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
- •Физико-химические основы коррозии и защиты металлов
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Химическая коррозия металлов – процесс, при котором окисление металла и восстановление окислителя происходят одновременно при их непосредственном взаимодействии
Mes + O2 → MexOy
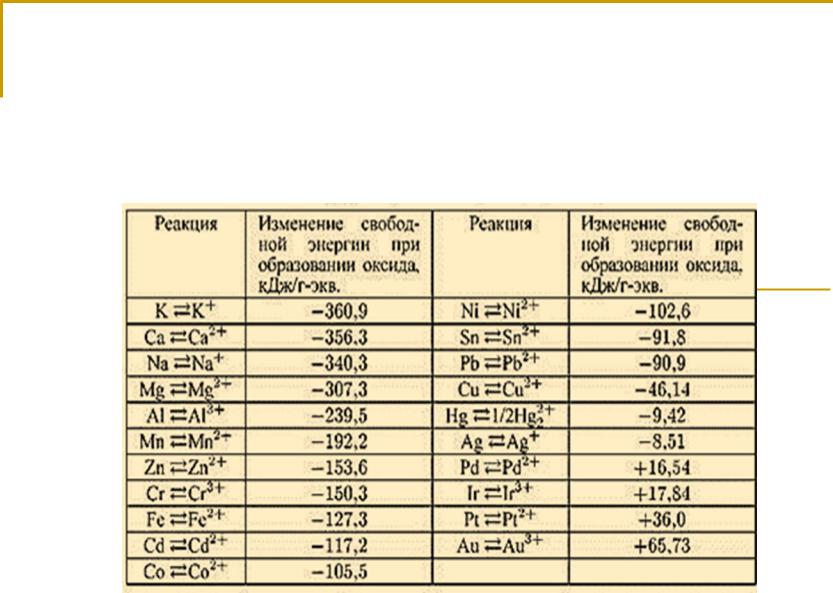
Изменение свободной энергии при образовании оксидов металлов
1
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
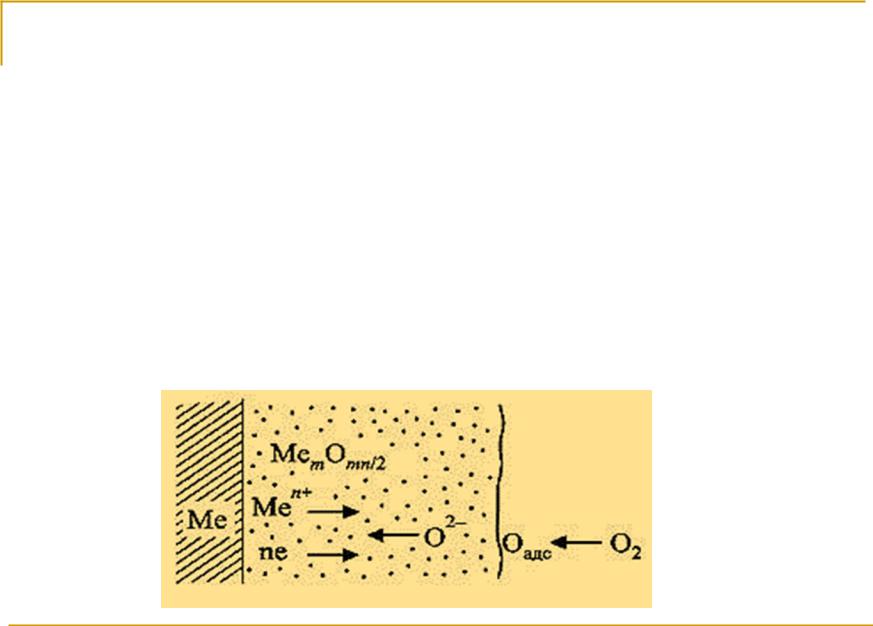
Стадии процесса:
1.Физическая адсорбция окислительного компонента среды: Me + O2 = MeO2адс
1.Химическая адсорбция окислителя с диссоциацией молекул кислорода: Me(тв) + {O2} = Me(тв) + 2Oадс
3. Диффузия кислорода по дефектам решетки с образованием слоя оксидов различного состава:
2

Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Оксидные слои на железе:
3

Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Характеристики оксидов железа: FeO – вюстит – черный порошок, не обладает защитными свойствами. При высокотемпературной газовой коррозии образуется Fe0,8-0,9O, по вакансиям кристаллической решетки
кислород проникает под слой оксида.
Fe2O3 – гематит – желто-коричневого цвета. Существует в
широком интервале температур, но выше 1100 ° С частично диссоциирует, используется в качестве пигмента.
FeO• Fe2O3 или Fe3O4 – магнетит, обладает магнитными свойствами и электронной проводимостью, дефекты в
структуре оксида обеспечивает легкость перехода электрона |
|
от одного катионного узла к другому. Магнетит устойчив во |
|
всем интервале температур от комнатной до точки плавления |
|
железа (1538 °С). Обладает высокими защитными свойствами. |
4 |
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
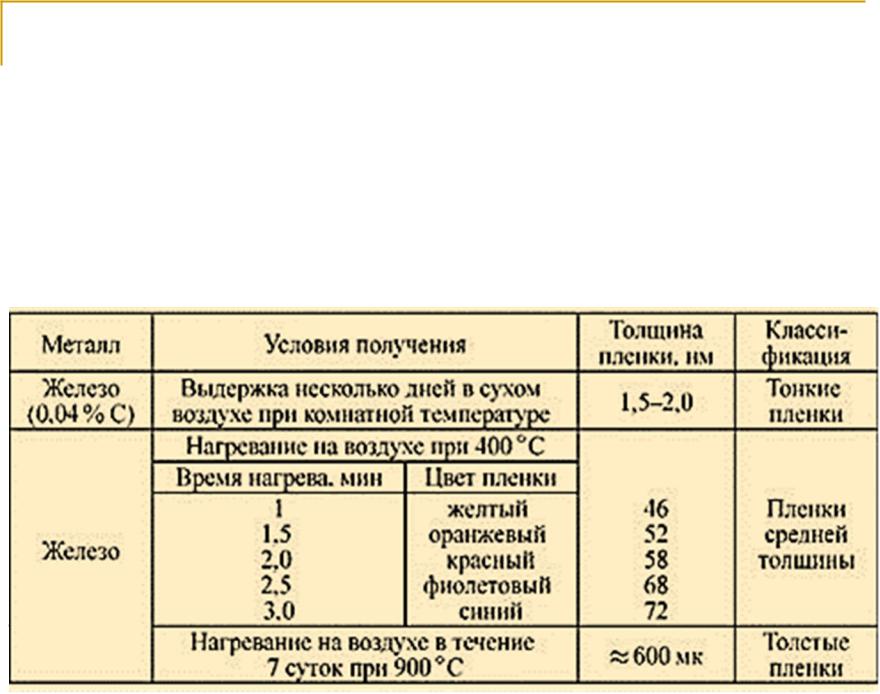
Классификация оксидных пленок по толщине:
-тонкие (невидимые) пленки толщиной от мономолекулярного слоя до 40 нм;
-средние пленки (видимые благодаря интерференционному окрашиванию как цвета побежалости), имеющие толщину 40-500 нм;
-толстые (видимые) пленки толщиной более 500 нм.
Толщина пленок на окисленном железе
5
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
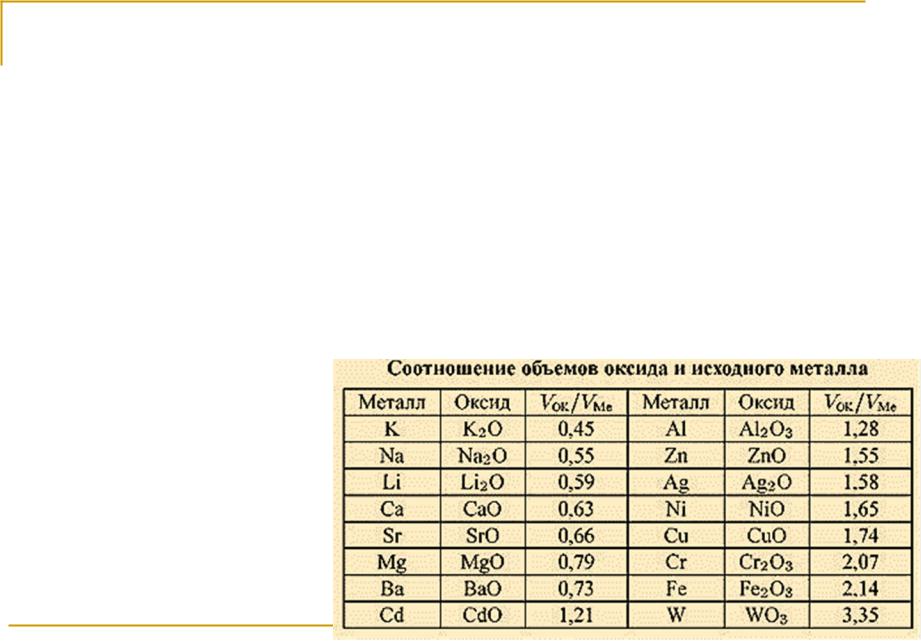
Защитные свойства оксидных пленок
Критерий сплошности Пиллинга-Бедворса: молярный объем оксида, возникающего на поверхности металла (Vok), должен быть больше молярного
объема металла (VMe), израсходованного на образование одного моля оксида:
Vok/VMe > 1
VMe= AMe / dMe ,
где AMe – атомная масса металла, dMe – плотность металла;
Vok= AOk / m dOk,
где Aok - молярная масса оксида, dok – плотность оксида, m - число атомов металла в
молекуле оксида
У пленок с Vok/VMe >>1 не может
быть высоких защитных свойств, ввиду возникновения в них больших внутренних напряжений (например, MoO3 или WO3).
В качестве верхней границы отношения объемов принимают величину 2,5. Тогда уточненное условие сплошности выглядит:
6
1 < V /V < 2,5.
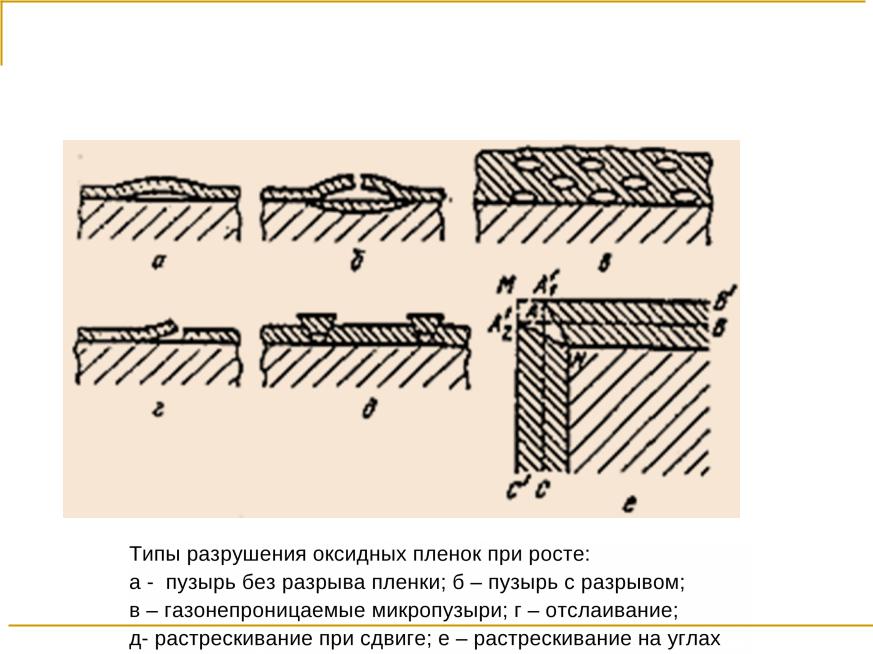
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Разрушение оксидных пленок
7
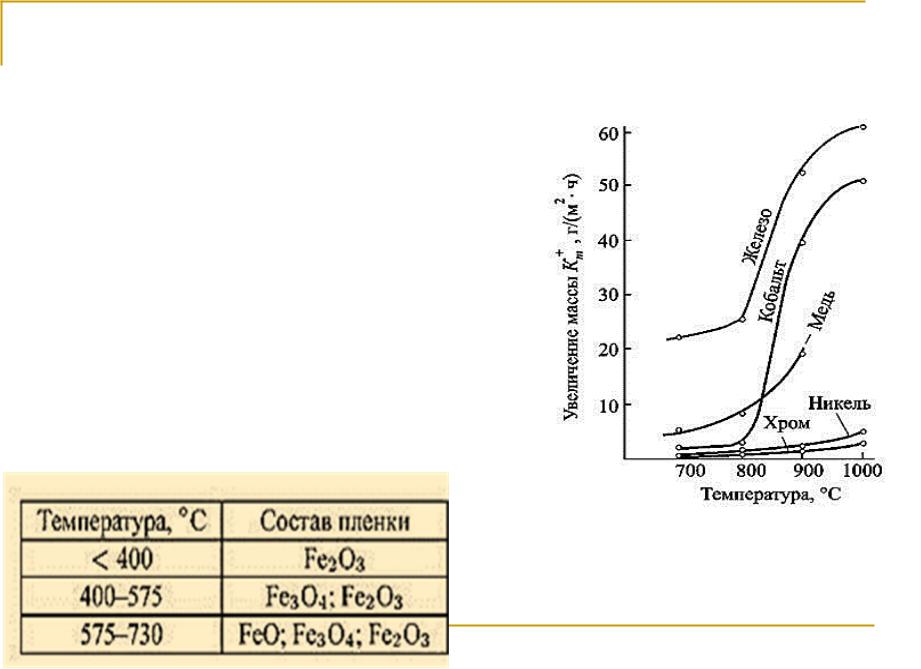
Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Влияние внешних факторов на химическую коррозию металлов 1. Температура
K = K0 * exp (-E*хp/RT),
где К0 - константа; Е*хp – энергия активации химической реакции; D = D0 * exp (-E*д/RT),
где D0 – константа; |
Е*д – энергия |
активации диффузии.
От температуры зависит состав оксидной пленки на стали:
8

Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Влияние внешних факторов на химическую коррозию металлов
2. Состав газовой фазы Важнейшие окислители металлов при высоких температурах – О2, СО2, Н2О(пар),
SO2:
2Me + O2 → 2MeO,
Me + CO2 → MeO + CO,
Me + H2O → MeO + H2, 3Me + SO2 → 2MeO + MeS,
В атмосферах, содержащих O2, CO2 и Н2О, может происходить обезуглероживание
(декарбонизация):
Fe3C + 1/2 O2 → 3Fe + CO,
Fe3C + CO2 → 3Fe + 2CO, Fe3C + H2O → 3Fe + CO + H2
V2O5 способен офлюсовывать (переводить в жидкое состояние) химические соединения золы и окалины:
4Fe + 3V2O5 = 2Fe2O3 + V2O3, |
|
V2O3 + O2 = V2O5, |
9 |

Физико-химические основы коррозии и защиты металлов
Лекция 2. Высокотемпературная газовая коррозия
Влияние внешних факторов на химическую коррозию металлов 3. Давление окислителя
Так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющей газа может быть различной в зависимости от строения защитной пленки.
Например, при окислении железа при 700-950оС скорость окисления не зависит от Po2.
4. Скорость движения газовой фазы
Окисление, как гетерогенный процесс, определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла.
5. Режим нагрева металла
Влияние режима нагрева металла может быть рассмотрено в контексте влияния колебаний температуры. То есть переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения
сохранности защитной пленки.
10
