
- •Электрохимическая
- •Введение
- •Электродный потенциал металла
- •Влияние величины электродного потенциала на направление электродной реакции
- •Уравнение Нернста
- •Измерение стандартных электродных потенциалов металлов
- •Стандартные электродные потенциалы
- •Электроды сравнения
- •Гальванический элемент Дж. Даниэля – Якоби (1836).
- •Гальванические элементы
- •Зависимость потенциала от рН
- •Диаграмма Пурбе
- •Поляризация электродов
- •Катодная деполяризация

Электрохимическая
коррозия
Плетнев Михаил Андреевич

Введение
Электрохимическая коррозия - взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте (пространственно разделены) и их скорости зависят от электродного потенциала (ГОСТ 5272-68)
Этот тип коррозии наиболее распространен. Он реализуется при взаимодействии металлических материалов с электролитами: водными растворами
солей, кислот, щелочей, расплавами солей и щелочей.

Электродный потенциал металла
Распределение потенциала в двойном электрическом слое: r – расстояние от поверхности металла
а |
б |
Два случая формирования потенциала: а – активный металл, отрицательный потенциал;
б – малоактивный металл, положительный потенциал

Влияние величины электродного потенциала на направление электродной реакции
1 - при отрицательном потенциале доминирует перенос электронов с электрода (восстановление Zn2+).
2 - при положительном потенциале доминирует перенос электронов на электрод (окисление Zn и выход ионов Zn2+ в раствор).
3 - при определенном электродном потенциале Eo устанавливается равновесие.

Уравнение Нернста
Eме = E0ме + (RT/nF)*lnaMen+,
где n -число моль-эквивалентов веществ, участвующих в реакции окисления; aMen+ - активность ионов металла в растворе;
E0ме - электродный потенциал металла в стандартных условиях, т.е. при aMen+,=1; R - универсальная газовая постоянная; F – число Фарадея; Т – температура по шкале Кельвина.
Если представить все константы при температуре 298К (25°С) и выразить зависимость в десятичных логарифмах, введя множитель 2.303, R =8,314 (Дж/К.моль), F=96500 К/экв, то
Eме = E0ме + (0,059/n)*lgaMen+

Измерение стандартных электродных потенциалов металлов
Ме

Стандартные электродные потенциалы
Электродная реакция |
Е0 |
Нейтральные среды (pH = 7) |
|
Аl(ОН)3 + 3е = Аl + 3ОН - |
-1,94 |
ZrO2+ 2Н2O + 4е = Zr+ 4OН - |
-1,54 |
ТiO2 + 2Н2O + 4е = Ti + 4OН - |
-1,27 |
Сr(ОН)3 + 3е = Сr + 3ОН - |
-0,886 |
Zn(OH)2 + 2е = Zn + 2OН - |
-0,83 |
Fe(OH)2 + 2е = Fe + 2OН - |
-0,463 |
Cd(OH)2 + 2е = Cd + 2OН - |
-0,395 |
Со(OH)2 + 2е = Со + 2OН - |
-0,316 |
Ni(OH)2 + 2е = Ni + 2OН - |
-0,306 |
PbO + Н2O + 2е = Pb + 2OН - |
-0,136 |
Cu(ОН)2 + 2е = Cu + 2OН - |
+0,19 |
AgCl + е = Ag + С1 - |
+0,222 |
Hg2(Cl2) + 2е = 2Hg + 2C1 - |
+0,268 |
O2 + 2H + + 4e = 2OH - |
+0,815 |
Сl2 + 2e = 2C1 - |
+1,360 |
Электродная реакция |
Е0 |
||||
Кислые среды (pH = 0) |
|
||||
H + + e = ½H2 |
|
|
0,000 |
||
Н + + Н2O + 2е = Н2 + ОН - |
-0,414 |
||||
O2 + 4H + + 4e = 2H2O |
+1,229 |
||||
Cr2O72- + 14H + + 6e = 2Cr3+ + 7H2O |
+1,33 |
||||
Щелочные среды (pH = 14) |
|
||||
Mg(OH) + 2e = Mg + 2OH - |
-2,69 |
||||
|
|
2 |
|
|
|
Mn(OH) + 2e = Mn + 2OH - |
-1,55 |
||||
|
|
2 |
|
|
|
2H O + 2e = H |
2 |
+ 2OH - |
-0,828 |
||
|
|
2 |
|
|
|
O |
2 |
+ 2Н O + 4e = 4OH - |
+0,401 |
||
|
2 |
|
|
|
|
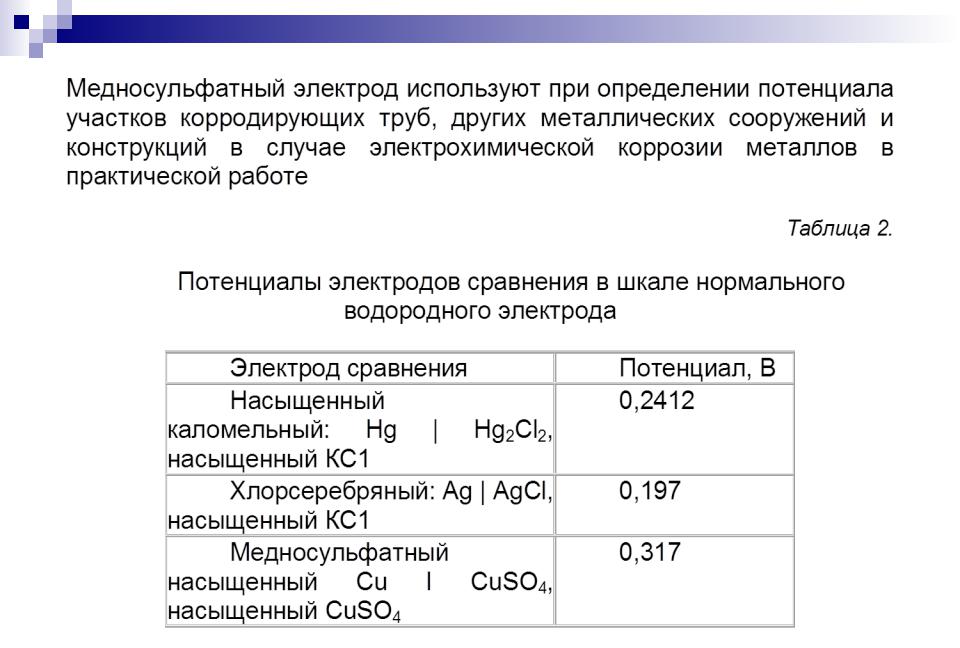
Электроды сравнения

Гальванический элемент Дж. Даниэля – Якоби (1836).

Гальванические элементы
В элементе происходит переход электронов от восстановителя к окислителю:
Zn + CuSO4 = Cu + ZnSO4 Окисление Zn: Zn – 2e = Zn2+ Восстановление Cu: Cu2+ + 2e = Cu
В электрохимических системах процессы окисления и восстановления пространственно разделены, электроны переходят от восстановителя (Zn) к окислителю (Cu) по внешнему проводнику (идет электрический ток).

При работе ГЭ происходят реакции: Анод: Zn – 2e = Zn2+ (окисление) Катод: Cu2+ + 2e = Cu (восстановление)
е- 
Z |
C |
n |
u |
ZnSO4 CuSO4
Схема записи ГЭ:
A(–) Zn l ZnSO4 ll CuSO4 l Cu (+) K E = φK – φA = 0,34 – (-0,76) = 1,1 В
Zn окисляется, т.к. его катионы переходят в раствор.
Cu восстанавливается, т.к. катионы меди превращаются в металлическую медь
