
- •В.Н. Диденко
- •Содержание
- •Фазовые превращения
- •Сложные системы
- •Фазовые переходы. Правило фаз Гиббса
- •Фазовые переходы в однокомпонентных системах
- •Однофазная однокомпонентная система
- •Двухфазная однокомпонентная система. Уравнение Клапейрона – Клаузиуса
- •Трехфазная однокомпонентная система
- •3.Фазовые диаграммы состояний
- •. Фазовая р-т диаграмма состояний
- •Фазовые p – V и t – s диаграммы состояний
- •Особые точки фазовых диаграмм
- •Тройная точка
- •Критическая точка
- •Закритическая область
- •3.5.Фазовые превращения углекислого газа
- •3.6. Кипение. Кавитация
- •Учебное издание
- •Диденко Валерий Николаевич
- •Варфоломеева Ольга Ивановна
- •Фазовые переходы
3.5.Фазовые превращения углекислого газа
Углекислый газ (СО2) широко используется в различных устройствах и процессах, поэтому его фазовые превращения представляют определенный практический интерес. На рис3.15. приведена фазовая Р-Т диаграмма углекислого газа с нанесенными значениями особых точек (тройной и критической), и значениями параметров насыщения для температуры 200С и нормального давления (Рн = 0,101325 МПа).
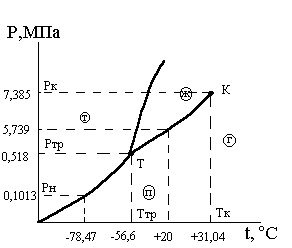
Рис.3.15. Фазовая Р-tдиаграмма
углекислого газа
Углекислый газ относится к нормальным
веществам (![]() ),
поэтому при температурах ниже тройной
точки (- 560С) жидкая углекислота
не существует ни при каком давлении.
),
поэтому при температурах ниже тройной
точки (- 560С) жидкая углекислота
не существует ни при каком давлении.
Если при температуре газа +200С давление в баллоне больше 5,739 МПа, то углекислота в баллоне находится в жидкой фазе. Невозможно увидеть жидкую углекислоту, выпуская ее из баллона в атмосферу через нижний вентиль, т.к. при атмосферном давлении (0,101325 МПа) жидкая фаза СО2не существует.
Сразу после выхода из баллона жидкая углекислота бурно испаряется вследствие понижения давления ниже давления насыщения при температуре окружающей среды.
При испарении теплота от окружающей среды отнимается, поэтому при истечении углекислоты из баллона окружающий воздух и нижний вентиль охлаждаются.
Как только температура охлаждения достигнет значения – 78,47 оС (температура сублимации СО2при нормальном давлении Рн), углекислота, вытекающая из баллона, из газообразной фазы будет переходить сразу в твердую фазу. Твердая фаза называемая «сухим льдом» (углекислотным снегом) собирается в мешок под струей.
Затем, забирая теплоту сублимации от окружающего воздуха, твердая углекислота снова превращается в газообразную. Температура в мешке будет оставаться постоянной и равной -78,47 оС, вплоть до полного исчезновения твердой фазы. «Сухим льдом» удобно пользоваться, например, для замораживания скоропортящихся продуктов. В отличие от СО2тройная точка воды находится при очень значительном разряжении (610 Па), поэтому при подводе теплоты ко льду при нормальном давлении (101325 Па) он сначала должен расплавится (растаять) и лишь затем превратиться в пар.
Твердая вода может сублимироваться при температурах ниже температуры тройной точки, что объясняет возможность сушки белья на морозе.
3.6. Кипение. Кавитация
Кипение возможно только тогда, когда давление пара внутри пузырьков будет больше внешнего давления. Чем ниже давление, тем ниже температура кипения. При низком давлении закипает холодная вода, но варить что-либо или заварить чай в таком холодном кипятке невозможно.
Если быстро откачивать из закрытого сосуда пар, то жидкость можно охлаждать или даже заморозить, т.к. теплота парообразования при этом отнимается от жидкости.
При высоких давлениях температура кипения воды может быть повышена настолько, что в некипящей воде можно расплавить олово (tпл=230оС) при р = 2,835 МПа или даже свинец (tпл=327оС) при р = 12,36 МПа.
Прочные герметичные сосуды, в которых получают особо высокие температуры жидкости при высоких давлениях, называются автоклавами. Автоклавы широко применяются в химической и пищевой промышленности. В парогенераторах также используется кипение при высоких давлениях.
Если давление жидкости сначала понижать до появления пузырьков пара, а затем повышать до конденсации пара и захлопывания пузырьков, то возникают локальные гидравлические удары.
Явление возникновения разрывов (пузырьков или каверн) в сплошности жидкости при локальном понижении давления называется кавитацией.
Литература
М.П. Вукалович, И.И. Новиков. Термодинамика. – М.: Машиностроение; 1972. – 670с.
С.И. Исаев. Курс химической термодинамики. – М.: Машиностроение; 1975. - 255с.
В.Н. Зубарев, А.А. Александров, В.С. Охотин. Практикум по технической термодинамике. – М.: Энергоатомиздат; 1986. – 304с.
