
- •В.Н. Диденко
- •Содержание
- •Фазовые превращения
- •Сложные системы
- •Фазовые переходы. Правило фаз Гиббса
- •Фазовые переходы в однокомпонентных системах
- •Однофазная однокомпонентная система
- •Двухфазная однокомпонентная система. Уравнение Клапейрона – Клаузиуса
- •Трехфазная однокомпонентная система
- •3.Фазовые диаграммы состояний
- •. Фазовая р-т диаграмма состояний
- •Фазовые p – V и t – s диаграммы состояний
- •Особые точки фазовых диаграмм
- •Тройная точка
- •Критическая точка
- •Закритическая область
- •3.5.Фазовые превращения углекислого газа
- •3.6. Кипение. Кавитация
- •Учебное издание
- •Диденко Валерий Николаевич
- •Варфоломеева Ольга Ивановна
- •Фазовые переходы
Закритическая область
В фазовой Р-Т диаграмме – это область, расположенная правее и выше критической точки, примерно там, куда можно было бы мысленно продолжить кривую насыщения.
В современных прямоточных паровых котлах парообразование осуществляется в закритической области.
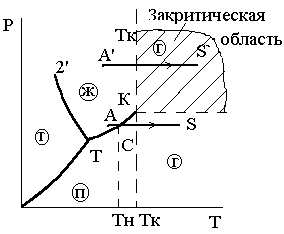
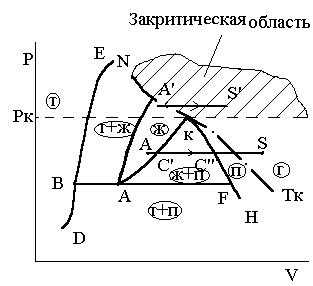
Рис.3.12. Фазовый переход в Рис.3.13. Фазовый переход в докритической
докритической и закритической и закритической областях Р-Vдиаграммы
областях Р-Т диаграммы
Термодинамические процессы в закритической области протекают с рядом отличительных особенностей.
Рассмотрим изобарный процесс ASв докритической области, т.е. при![]() .
Точка А соответствует жидкой фазе
вещества, которая при достижении
температуры Тнначинает превращаться
в пар. Этому фазовому переходу соответствует
точка В на рис.3.12 и отрезок В'В'' на рис
3.13. При переходе через кривую насыщения
ТК свойства вещества изменяются скачком.
ТочкаSсоответствует
газообразной фазе вещества.
.
Точка А соответствует жидкой фазе
вещества, которая при достижении
температуры Тнначинает превращаться
в пар. Этому фазовому переходу соответствует
точка В на рис.3.12 и отрезок В'В'' на рис
3.13. При переходе через кривую насыщения
ТК свойства вещества изменяются скачком.
ТочкаSсоответствует
газообразной фазе вещества.
Рассмотрим изобарный процесс A'S'
при давлении![]() .
В точке А' вещество находится в жидкой
фазе, а в точкеS'- в
газообразной, т.е. в различных фазовых
состояниях. Но при переходе от точкиA'
кS' скачкообразного
изменения свойств не происходит: свойства
вещества меняются непрерывно и постепенно.
Скорость этого изменения свойств
вещества на линииA'S'
различна: мала вблизи точек А' иS'
и резко возрастает при входе в закритическую
область. На любой изобаре в закритической
области можно указать точки максимальной
скорости изменения: температурного
коэффициента объемного расширения
вещества
.
В точке А' вещество находится в жидкой
фазе, а в точкеS'- в
газообразной, т.е. в различных фазовых
состояниях. Но при переходе от точкиA'
кS' скачкообразного
изменения свойств не происходит: свойства
вещества меняются непрерывно и постепенно.
Скорость этого изменения свойств
вещества на линииA'S'
различна: мала вблизи точек А' иS'
и резко возрастает при входе в закритическую
область. На любой изобаре в закритической
области можно указать точки максимальной
скорости изменения: температурного
коэффициента объемного расширения
вещества![]() , энтальпии, внутренней энергии, вязкости,
теплопроводности и т.д.
, энтальпии, внутренней энергии, вязкости,
теплопроводности и т.д.
Таким образом, в закритической области развиваются явления, похожие на фазовые переходы, но двухфазное состояние вещества «жидкость - газ» при этом не наблюдается. Кроме этого, границы закритической области размыты.
При Р<Рк, т.е. в докритической области, на фазовое превращение «жидкость - пар» требуется затратить скрытую теплоту парообразования, которая является как бы «тепловым барьером» между жидкой и паровой фазами.
Нечто подобное наблюдается в закритической области. На рис3.14 представлена типичная картина изменения удельной изобарной теплоемкости при Р>Рк.

Рис.3.14. Удельная изобарная
теплоемкости при закритическом
давлении.
Так как Qр =![]() СрdТ
, то площадь под кривой Ср(Т) – это
теплота, необходимая для превращения
жидкости (точка А’) в газ (точкаS’)
при закритическом давлении. Пунктирной
линией А’МS’ показана
типичная зависимость Ср от температуры
в докритическойобласти.
СрdТ
, то площадь под кривой Ср(Т) – это
теплота, необходимая для превращения
жидкости (точка А’) в газ (точкаS’)
при закритическом давлении. Пунктирной
линией А’МS’ показана
типичная зависимость Ср от температуры
в докритическойобласти.
Таким образом, максимумы на кривой Ср(Т) в закритической области, означающие дополнительные затраты теплоты на нагревание вещества, также выполняют схожие функции «теплового барьера» между жидкостью и газом в этой области.
Как показали исследования, положения
максимумов
![]() не совпадают, что свидетельствует об
отсутствии единой линии раздела жидкости
и пара в закритической области. В ней
существует лишь широкая и размытая
зона, где превращение жидкости в пар
происходит наиболее интенсивно.
не совпадают, что свидетельствует об
отсутствии единой линии раздела жидкости
и пара в закритической области. В ней
существует лишь широкая и размытая
зона, где превращение жидкости в пар
происходит наиболее интенсивно.
Наиболее интенсивно эти превращения происходят при давлениях, не слишком превышающих критическое (Рк). По мере повышения давления явления превращение жидкости в пар сглаживаются и при больших давлениях проявляются очень слабо.
Таким образом, при Р>Рксуществуют, но не могут сосуществовать одновременно и равновесно жидкая фаза, газообразная фаза и некоторая промежуточная фаза. Эту промежуточную фазу иногда называютметафазой , она сочетает в себе свойства жидкости и газа.
Из-за резкого изменения термодинамических параметров, теплофизических характеристик и характеристических функций в закритической области погрешности их экспериментального определения в этой области в десять с лишним раз больше, чем при докритических давлениях.
