
- •§1. Несколько вводных замечаний о предмете физики.
- •§2. Механика
- •2.2. Кинематика движения материальной точки. Характеристики движения.
- •2.3. Вектор скорости. Средняя и мгновенная скорость.
- •2.4. Путь при неравномерном движении.
- •2.6. Криволинейное движение.
- •2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение).
- •2.7. Кинематика вращательного движения.
- •2.7.1. Угловая скорость.
- •2.7.2. Угловое ускорение.
- •2.7.3. Связь между линейной и угловой скоростью.
- •§3. Динамика
- •3.2.IIзакон Ньютона.
- •3.3.IiIзакон Ньютона.
- •3.4. Импульс. Закон сохранения импульса.
- •3.5. Работа и энергия.
- •3.6. Мощность.
- •3.7. Энергия.
- •3.8. Кинетическая энергия тела.
- •3.9. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли).
- •3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения).
- •3.12. Потенциальная энергия упруго деформированного тела.
- •3.13. Закон сохранения энергии.
- •§4. Механика твердого тела.
- •4.1. Поступательное движение твердого тела.
- •4.2. Вращательное движение твердого тела.
- •4.3. Момент импульса тела.
- •4.4. Закон сохранения момента импульса.
- •4.5. Основное уравнение динамики вращательного движения.
- •4.6. Кинетическая энергия вращающегося твердого тела.
- •4.7. Работа внешних сил при вращательном движении твердого тела.
- •§5. Гидродинамика
- •5.1. Линии и трубки тока.
- •5.2. Уравнение Бернулли.
- •5.3. Силы внутреннего трения.
- •5.4. Ламинарное и турбулентное течения.
- •5.5. Течение жидкости в круглой трубе.
- •5.6. Движение тел в жидкостях и газах.
- •§6. Всемирное тяготение.
- •6.1. Законы Кеплера.
- •6.2. Опыт Кавендиша.
- •6.3. Напряженность гравитационного поля. Потенциал гравитационного поля.
- •§7. Основы теории относительности.
- •7.1. Принцип относительности.
- •7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца
- •7.3. Следствия из преобразований Лоренца.
- •7.4. Интервал между событиями.
- •§8. Колебания.
- •8.1. Общие сведения.
- •8.2. Уравнение гармонического колебательного движения.
- •8.3. Графическое изображение гармонических колебаний. Векторная диаграмма.
- •8.4. Скорость, ускорение и энергия колеблющегося тела.
- •8.5. Гармонический осциллятор.
- •8.6. Малые колебания системы вблизи положения равновесия.
- •8.7. Математический маятник.
- •8.8. Физический маятник.
- •8.9. Затухающие колебания.
- •8.10. Вынужденные колебания. Резонанс.
- •Молекулярная физика и термодинамика §9. Молекулярная физика
- •9.1. Предмет и методы молекулярной физики.
- •9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние.
- •9.2.1. Идеальный газ. Параметры состояния идеального газа.
- •9.2.2. Газовые законы.
- •9.2.3. Закон Авогадро.
- •9.2.4. Уравнение состояния идеального газа (уравнение МенделееваКлапейрона).
- •Физический смысл универсальной газовой постоянной.
- •9.2. Основное уравнение кинетической теории газов
- •9.3. Барометрическая формула. Распределение Больцмана
- •9.4. Максвелловское распределение молекул по скоростям
- •9.5. Явления переноса. Длина свободного пробега молекул
- •9.6. Явление диффузии
- •9.7. Явление теплопроводности и вязкости
- •§10. Термодинамика
- •10.1. Внутренняя энергия идеального газа
- •10.2. Работа и теплота. Первое начало термодинамики
- •10.3. Работа газовых изопроцессов
- •10.4. Молекулярно-кинетическая теория теплоемкостей
- •10.5. Адиабатический процесс
- •10.6. Круговые обратимые процессы. Цикл Карно
- •10.7. Понятие об энтропии. Энтропия идеального газа
- •10.8. Второе начало термодинамики
- •10.9. Статистическое толкование второго начала термодинамики
- •§11. Реальные газы
- •11.1. Уравнение Ван-дер-Ваальса
- •11.2. Критическое состояние вещества
- •11.3. Эффект Джоуля-Томсона
- •§1. Несколько вводных замечаний о предмете физики. 1
11.2. Критическое состояние вещества
В
Р

Если изотермически сжимать газ при температуре, меньшей Tкр (изотерма дляT = T1), то газ перейдет в двухфазное состояние и затем в жидкое. Газообразное состояние приT Tкрчасто называют паром. Легко видеть, что, еслиT Tкр, то, сжимая газ изотермически, его нельзя превратить в жидкость (изотерма дляT = T2 ). Это обстоятельство позволило понять, что любой газ можно превратить в жидкость, лишь охладив его до температуры ниже критической и сжимая его. Это предположение впервые высказал Д.И. Менделеев, и он же впервые ввел понятие критической температуры, проводя исследования коэффициента поверхностного натяжения. Учитывая вышесказанное, ученым удалось сжижить все известные газы.
При критическом состоянии различие в плотности жидкости и насыщенного пара пропадает. Критическое состояние представляет собой смесь частичек жидкости и пара, которые непрерывно распадаются, превращаясь друг в друга. Вещество при подходе к критической точке мутнеет, так как свет сильно рассеивается на этих неоднородностях среды.
11.3. Эффект Джоуля-Томсона
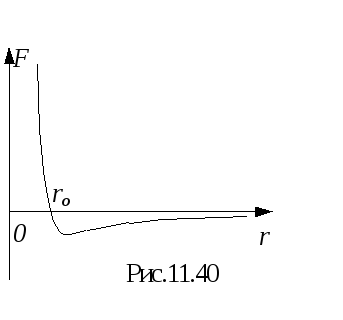
В реальном газе между молекулами действуют силы притяжения и отталкивания. Силы притяжения обусловлены дипольным взаимодействием молекул. Некоторые молекулы могут представлять собой постоянные диполи. Для неполярных молекул основой притяжения является взаимодействие мгновенных осциллирующих диполей. Силы отталкивания обусловлены взаимодействием электронных оболочек молекул. Они проявляются в основном при сближении молекул и быстро убывают с увеличением расстояния между молекулами. Силы же притяжения наоборот преобладают при большом расстоянии между молекулами. Результирующая сила взаимодействия двух молекул равна сумме этих сил и имеет вид, изображенный на рис. 11.4 . При расстоянии между молекулами r = ro сила отталкивания равна силе притяжения и результирующая сила F = 0 . При расстоянии между молекуламиr ro преобладает сила отталкивания, при расстоянииr ro преобладает сила притяжения.

ЛЕКЦИЯ 1 1
