
- •I Механика
- •§1 Основные кинематические характеристики движения материальной точки
- •§2 Криволинейное движение материальной точки. Нормальная и тангенциальная составляющие ускорения при криволинейном движении
- •§3 Движение материальной точки по окружности. Связь угловых и линейных величин
- •§4 Частные случаи движения материальной точки
- •1. Движение с постоянной скоростью
- •2. Движение материальной точки с постоянным ускорением
- •3. Движение материальной точки по окружности с постоянной угловой скоростью
- •Тема 2. Динамика
- •§5 Законы динамики Ньютона.
- •Тема 3. Законы сохранения в механике
- •§6. Законы сохранения в механике.
- •§7. Работа и мощность. Кинетическая энергия
- •§8. Консервативные (потенциальные) силы.
- •§9. Потенциальная энергия.
- •§10. Потенциальная энергия взаимодействия.
- •§11. Закон сохранения энергии в механике.
- •§12. Кинетическая энергия вращательного движения твердого тела. Момент инерции тел
- •§13. Теорема Штейнера о моменте инерции относительно произвольной оси
- •§14. Основное уравнение динамики вращательного движения
- •§15. Момент импульса.
- •§16. Плоское движение. Энергия плоского движения
- •Тема 4. Механические колебания
- •§17. Свободные незатухающие колебания
- •§18. Свободные затухающие колебания
- •§19. Вынужденные колебания. Резонанс
- •§20. Сложение колебаний
- •II Молекулярная физика. Термодинамика
- •§21. Термодинамика и молекулярно-кинетическая теория в изучении тепловых явлений. Основные макроскопические параметры газообразных тел
- •§22. Уравнение состояния идеального газа.
- •§23. Барометрическая формула.
- •§24. Распределение Максвелла
- •§25. График функции распределения Максвелла. Расчёт наиболее вероятной средней арифметической и средней квадратичной скоростей с помощью функции распределения Максвелла
- •§26. Внутренняя энергия идеального газа.
- •§27. Работа газа при изменении его объёма.
- •2) Первое начало термодинамики.
- •§28. Теплоёмкость. Теплоёмкость идеального газа. Уравнение Майера
- •§29. Состояние тд системы. Равновесные процессы
- •§30. Адиабатный процесс.
- •§31. Политропические процессы
- •§32. Макро- и микросостояния.
- •§33. Примеры расчета изменения энтропии
- •§34. Закон увеличения энтропии (II начало тд).
- •§35. Тепловые двигатели. 2-ое начало тд
- •§36. Кпд тепловой машины. Цикл Карно.
§24. Распределение Максвелла
Это распределение молекул газа по скоростям. Рассуждение не строгое на основе аналогий.
Распределение Больцмана даёт возможность определить концентрацию молекул газа в зависимости от их потенциальной энергии, однако логично предположить, что подобное распределение молекул и для кинетической энергии поступательного движения молекул газа.
Но если потенциальная энергия есть
функция координат молекулы, то её
кинетическая энергия (есть функция
координат скорости
![]()
![]()
В силу этого величина концентрации
является функцией координат вектора
скорости
![]() ,
то есть речь идёт о концентрации молекул
в пространстве скоростей.
,
то есть речь идёт о концентрации молекул
в пространстве скоростей.
|
|
Пространство скоростей задаётся тремя
взаимно ортогональными осями
|
вектора скорости в данный момент времени, то есть вектор электронов в пространстве скоростей выполняет роль радиус-вектора в обычном пространстве.
![]()

Элементарный объём пространства
скоростей
![]() ,
тогда число частиц в этом объёме
,
тогда число частиц в этом объёме

![]()

По аналогии с распределением Больцмана можно предположить:

Определим постоянную С, учитывая, что общее число молекул газа во всём пространстве скоростей равно N.
Суммирование всех молекул сводится к интегрированию по всему пространству скоростей

Такое интегрирование с учётом того, что
![]() не зависит от
не зависит от![]() и
и![]() ,
сводится к перемножению трёх интегралов
,
сводится к перемножению трёх интегралов

Все три интеграла равны друг другу. Достаточно определить один из них.

 -
интеграл Пуассона
-
интеграл Пуассона
![]() ,
получаем
,
получаем

Таким образом, число молекул в элементарном объёме пространства скоростей будет равно

![]()

Или концентрация в пространстве скоростей равна

Если концентрацию в пространстве
скоростей умножить на элементарный
объём шарового слоя радиуса
![]() толщиной
толщиной![]() ,
в пределах такого слоя величину
концентрации можно считать постоянной,
то мы получим число молекул, лежащих
внутри такого слоя.
,
в пределах такого слоя величину
концентрации можно считать постоянной,
то мы получим число молекул, лежащих
внутри такого слоя.
|
|
dN- число молекул, модуль
скорости которых лежит в интервале
от
|
![]() - функция распределения Максвелла.
- функция распределения Максвелла.
![]()

§25. График функции распределения Максвелла. Расчёт наиболее вероятной средней арифметической и средней квадратичной скоростей с помощью функции распределения Максвелла
![]()

Сначала выясним, что при
![]() ,
а при
,
а при![]() .
.
Найдём экстремум этой положительной функции.

В области
![]() функция имеет единственный экстремум,
являющийся максимумом в силу положительности
функции
функция имеет единственный экстремум,
являющийся максимумом в силу положительности
функции![]() .
Значение скорости, при которой он
наблюдается, называется наиболее
вероятной скоростью
.
Значение скорости, при которой он
наблюдается, называется наиболее
вероятной скоростью

![]() - масса одной молекулы.
- масса одной молекулы.
С ростом температуры
![]() увеличивается, а
увеличивается, а![]() - уменьшается.
- уменьшается.
Построим с учётом сказанного график
функции
![]() :
:![]() и
и![]() (
(![]() ).
).
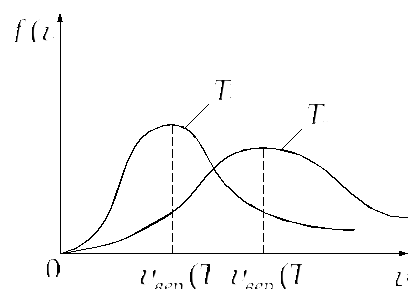
Площадь под этой кривой равна
![]() ,
а
,
а![]() - площадь под кривой в интервале этих
скоростей.
- площадь под кривой в интервале этих
скоростей.
Используя функцию распределения
Максвелла, можно определить среднее
значение модуля скорости молекул газа
-
![]() ,
которое есть среднее арифметическое
скоростей молекул.
,
которое есть среднее арифметическое
скоростей молекул.
Для того, чтобы понять, как это можно сделать, обратимся сначала к случаю дискретного распределения некоторых частиц по скорости.
Пусть
![]() - число частиц, обладающих скоростью
- число частиц, обладающих скоростью![]() ,
,![]() - число частиц, обладающих скоростью
- число частиц, обладающих скоростью![]() ,
,![]() -
-![]() .
Тогда среднее арифметическое абсолютного
значения скорости частиц равно:
.
Тогда среднее арифметическое абсолютного
значения скорости частиц равно:
![]() .
.
В случае непрерывного распределения молекул газа по скоростям (т.е. в случае очень большого количества частиц) сумма в предыдущем выражении заменяется интегралом.

Аналогично, можно найти среднее значение квадрата скорости молекул газа
![]() .
.
Учитывая это, получим что
![]() .
.
Этим результатом мы воспользовались ранее при выводе уравнения идеального газа (т.е. логически следовало бы выводить сначала распределение Максвелла, а следом уравнение состояния идеального газа).
Величина, равная
![]() ,
равна
,
равна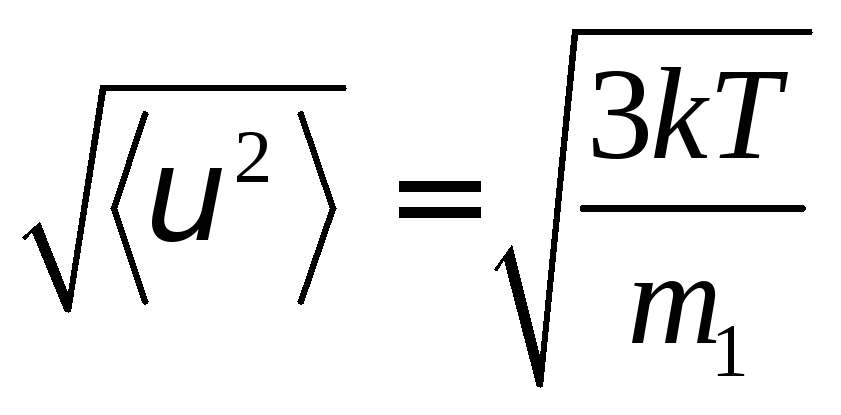 и именуется средней квадратичной
скоростью.
и именуется средней квадратичной
скоростью.
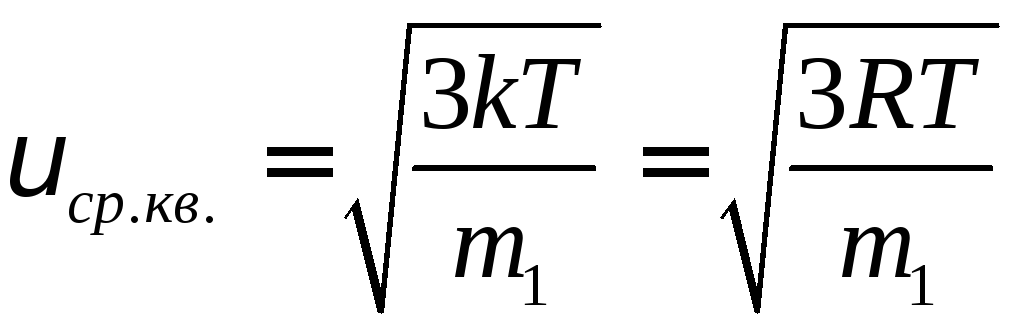
На графике функции распределения Максвелла отметим эти скорости.




