
- •I Механика
- •§1 Основные кинематические характеристики движения материальной точки
- •§2 Криволинейное движение материальной точки. Нормальная и тангенциальная составляющие ускорения при криволинейном движении
- •§3 Движение материальной точки по окружности. Связь угловых и линейных величин
- •§4 Частные случаи движения материальной точки
- •1. Движение с постоянной скоростью
- •2. Движение материальной точки с постоянным ускорением
- •3. Движение материальной точки по окружности с постоянной угловой скоростью
- •Тема 2. Динамика
- •§5 Законы динамики Ньютона.
- •Тема 3. Законы сохранения в механике
- •§6. Законы сохранения в механике.
- •§7. Работа и мощность. Кинетическая энергия
- •§8. Консервативные (потенциальные) силы.
- •§9. Потенциальная энергия.
- •§10. Потенциальная энергия взаимодействия.
- •§11. Закон сохранения энергии в механике.
- •§12. Кинетическая энергия вращательного движения твердого тела. Момент инерции тел
- •§13. Теорема Штейнера о моменте инерции относительно произвольной оси
- •§14. Основное уравнение динамики вращательного движения
- •§15. Момент импульса.
- •§16. Плоское движение. Энергия плоского движения
- •Тема 4. Механические колебания
- •§17. Свободные незатухающие колебания
- •§18. Свободные затухающие колебания
- •§19. Вынужденные колебания. Резонанс
- •§20. Сложение колебаний
- •II Молекулярная физика. Термодинамика
- •§21. Термодинамика и молекулярно-кинетическая теория в изучении тепловых явлений. Основные макроскопические параметры газообразных тел
- •§22. Уравнение состояния идеального газа.
- •§23. Барометрическая формула.
- •§24. Распределение Максвелла
- •§25. График функции распределения Максвелла. Расчёт наиболее вероятной средней арифметической и средней квадратичной скоростей с помощью функции распределения Максвелла
- •§26. Внутренняя энергия идеального газа.
- •§27. Работа газа при изменении его объёма.
- •2) Первое начало термодинамики.
- •§28. Теплоёмкость. Теплоёмкость идеального газа. Уравнение Майера
- •§29. Состояние тд системы. Равновесные процессы
- •§30. Адиабатный процесс.
- •§31. Политропические процессы
- •§32. Макро- и микросостояния.
- •§33. Примеры расчета изменения энтропии
- •§34. Закон увеличения энтропии (II начало тд).
- •§35. Тепловые двигатели. 2-ое начало тд
- •§36. Кпд тепловой машины. Цикл Карно.
§22. Уравнение состояния идеального газа.
Уравнение Дальтона
Уравнение, связывающее все три параметра: давление, объём, температуру, называется уравнением состояния газа:
![]() .
.
Идеальный газ – некая абстракция, под которой понимают следующую модель: размерами молекул газа можно пренебречь по сравнению с расстоянием между ними, силами межмолекулярного взаимодействия можно пренебречь, исключая процессы соударения между ними, как абсолютно упругими шариками.
Пусть идеальный газ находится в сферическом сосуде радиуса R. Найдём давление, которое газ оказывает на стенки сосуда.
|
|
Молекула с номером i, массой
|
Время
![]() между соударениями молекул равно:
между соударениями молекул равно:![]() ,
тогда средняя сила действующая на стенку
со стороны i-той молекулы:
,
тогда средняя сила действующая на стенку
со стороны i-той молекулы:
![]() ,
а сила действия со стороны всех молекул
газа равна:
,
а сила действия со стороны всех молекул
газа равна:![]() .
.
Давление же будет
![]()
Учитывая, что
![]() ,
получим
,
получим
![]()
![]() - концентрация молекул в единице объёма.
- концентрация молекул в единице объёма.
![]() - основное уравнение МКТ.
- основное уравнение МКТ.
Учитывая, что
![]() ,
получим
,
получим
![]() - основное уравнение состояния идеального
газа.
- основное уравнение состояния идеального
газа.
Представив, что
![]() ,
,
![]() - универсальная газовая постоянная,
получим уравнение Клапейрона-Менделеева
- универсальная газовая постоянная,
получим уравнение Клапейрона-Менделеева
![]() - уравнение состояния идеального газа.
- уравнение состояния идеального газа.
Закон Дальтона.
Рассмотрим газовую смесь, состоящую из
n-компонентов. Обозначим![]() -
количество молей i-той константы смеси,
-
количество молей i-той константы смеси,![]() - число молей i-той константы.
- число молей i-той константы.
Давление, которое оказывал бы какой-либо из газов (констант) в отсутствии всех остальных компонентов называется парциальным давлением этого газа.
Согласно определению парциальное
давление i-той константы этого газа
равно:
![]() .
.
Тогда суммы парциальных давлений газов,
входящих в смесь равна соответственно
![]() .
(*)
.
(*)
С другой стороны, согласно уравнению
состояния идеального газа
![]() ,
где
,
где

Сопоставляя (*) и (**)
![]()
Давление смеси газов равно сумме парциальных давлений газовых компонент, входящих в смесь – закон Дальтона.
§23. Барометрическая формула.
Распределение Больцмана
Рассмотрим каким образом ведёт себя идеальный газ в поле силы тяжести Земли. Выделим для этого мысленно в газе вертикальный столб с площадью поперечного сечения S.
|
|
Выделим из этого столба бесконечно тонкий слой dz.
Силу, с которой газ, находящийся выше,
давит на нижнее основание слоя на
высоте zобозначим заF, на высоте
|
Тогда приращение давления
![]() ,
вызванное действием силы тяжести, будет
,
вызванное действием силы тяжести, будет![]() .
Из уравнения Клапейрона-Менделеева
.
Из уравнения Клапейрона-Менделеева![]() выразим плотность
выразим плотность![]() ,
тогда
,
тогда![]() ,
положим
,
положим![]()
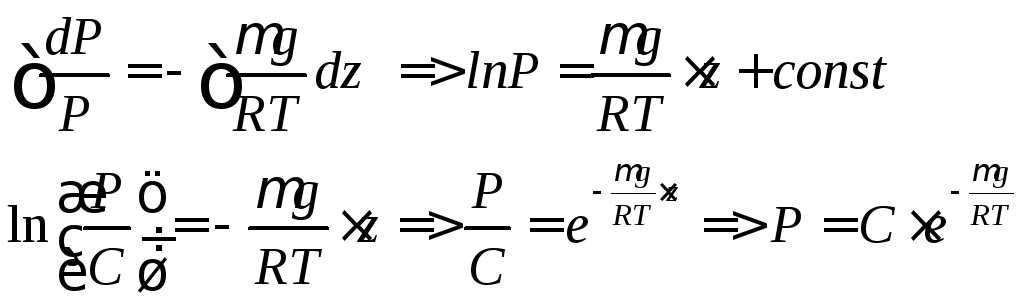
Обозначим давление при z=0![]()
![]() - данное выражение называется
барометрической формулой и показывает
зависимость давления идеального газа
от высоты при постоянной температуре
газа.
- данное выражение называется
барометрической формулой и показывает
зависимость давления идеального газа
от высоты при постоянной температуре
газа.
Используя соотношение, что
![]() ,
запишем барометрическую формулу для
концентрации.
,
запишем барометрическую формулу для
концентрации.
![]() ,
где
,
где![]() - концентрация у поверхности Земли.
- концентрация у поверхности Земли.
Изобразим эту зависимость графически
для двух газов, имеющих одинаковую
концентрацию молекул
![]() у поверхности Земли, но разные молекулярные
массы
у поверхности Земли, но разные молекулярные
массы![]() и
и![]() .
.
|
|
Эта зависимость показывает, что газ являющийся смесью газов с увеличением высоты обогащается более лёгкими компонентами. |
Такое утверждение справедливо и для нашей воздушной атмосферы. Верхние слои атмосферы обеднены кислородом и обогащены водородом, и в горах трудно дышать из-за нехватки кислорода, а не из-за перепада давления.
Барометрическую формулу можно использовать для расчёта высоты полёта летательных аппаратов, измеряя давление на борту и зная его у поверхности Земли, вводя поправку на изменение температуры. Предназначенный для этой цели барометр, проградуированный в значениях высоты, называется альтиметр.
Учитывая, что
![]() ,
а
,
а![]() барометрическую формулу для концентрации
можно записать
барометрическую формулу для концентрации
можно записать
![]() .
.
Однако, учитывая что
![]() ,
где П - потенциальная энергия молекулы
в поле силы тяжести Земли, то можно
записать барометрическую формулу так
(
,
где П - потенциальная энергия молекулы
в поле силы тяжести Земли, то можно
записать барометрическую формулу так
(![]() )
)
![]() (***)
(***)
Больцман показал, что записанная формула (***) справедлива в случае потенциального силового поля любой природы для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения при постоянной температуре. В связи с этим зависимость концентрации частиц от их потенциальной энергии называется функция распределения Больцмана (распределение по координатам).
В общем случае потенциальная энергия частицы является функцией трёх её координат, в силу чего и концентрация является функцией координат:
![]() ,
,
![]() - концентрация в точках, где
- концентрация в точках, где![]() .
.
В заключении отметим, что число частиц
![]() в элементарном объёме пространства
в элементарном объёме пространства![]() в близи точки с координатами
в близи точки с координатами![]() равно
равно
![]() .
.



