
- •§1. Несколько вводных замечаний о предмете физики.
- •§2. Механика
- •2.2. Кинематика движения материальной точки. Характеристики движения.
- •2.3. Вектор скорости. Средняя и мгновенная скорость.
- •2.4. Путь при неравномерном движении.
- •2.6. Криволинейное движение.
- •2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение).
- •2.7. Кинематика вращательного движения.
- •2.7.1. Угловая скорость.
- •2.7.2. Угловое ускорение.
- •2.7.3. Связь между линейной и угловой скоростью.
- •§3. Динамика
- •3.2. IIзакон Ньютона.
- •3.3. IiIзакон Ньютона.
- •3.4. Импульс. Закон сохранения импульса.
- •3.5. Работа и энергия.
- •3.6. Мощность.
- •3.7. Энергия.
- •3.8. Кинетическая энергия тела.
- •3.9. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли).
- •3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения).
- •3.12. Потенциальная энергия упруго деформированного тела.
- •3.13. Закон сохранения энергии.
- •§4. Механика твердого тела.
- •4.1. Поступательное движение твердого тела.
- •4.2. Вращательное движение твердого тела.
- •4.3. Момент импульса тела.
- •4.4. Закон сохранения момента импульса.
- •4.5. Основное уравнение динамики вращательного движения.
- •4.6. Кинетическая энергия вращающегося твердого тела.
- •4.7. Работа внешних сил при вращательном движении твердого тела.
- •§5. Гидродинамика
- •5.1. Линии и трубки тока.
- •5.2. Уравнение Бернулли.
- •5.3. Силы внутреннего трения.
- •5.4. Ламинарное и турбулентное течения.
- •5.5. Течение жидкости в круглой трубе.
- •5.6. Движение тел в жидкостях и газах.
- •§6. Всемирное тяготение.
- •6.1. Законы Кеплера.
- •6.2. Опыт Кавендиша.
- •6.3. Напряженность гравитационного поля. Потенциал гравитационного поля.
- •§7. Основы теории относительности.
- •7.1. Принцип относительности.
- •7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца
- •7.3. Следствия из преобразований Лоренца.
- •7.4. Интервал между событиями.
- •§8. Колебания.
- •8.1. Общие сведения.
- •8.2. Уравнение гармонического колебательного движения.
- •8.3. Графическое изображение гармонических колебаний. Векторная диаграмма.
- •8.4. Скорость, ускорение и энергия колеблющегося тела.
- •8.5. Гармонический осциллятор.
- •8.6. Малые колебания системы вблизи положения равновесия.
- •8.7. Математический маятник.
- •8.8. Физический маятник.
- •8.9. Затухающие колебания.
- •8.10. Вынужденные колебания. Резонанс.
- •Молекулярная физика и термодинамика §9. Молекулярная физика
- •9.1. Предмет и методы молекулярной физики.
- •9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние.
- •9.2.1. Идеальный газ. Параметры состояния идеального газа.
- •9.2.2. Газовые законы.
- •9.2.3. Закон Авогадро.
- •9.2.4. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона).
- •Физический смысл универсальной газовой постоянной.
- •9.2. Основное уравнение кинетической теории газов
- •9.3. Барометрическая формула. Распределение Больцмана
- •9.4. Максвелловское распределение молекул по скоростям
- •9.5. Явления переноса. Длина свободного пробега молекул
- •9.6. Явление диффузии
- •9.7. Явление теплопроводности и вязкости
- •§10. Термодинамика
- •10.1. Внутренняя энергия идеального газа
- •10.2. Работа и теплота. Первое начало термодинамики
- •10.3. Работа газовых изопроцессов
- •10.4. Молекулярно-кинетическая теория теплоемкостей
- •10.5. Адиабатический процесс
- •10.6. Круговые обратимые процессы. Цикл Карно
- •10.7. Понятие об энтропии. Энтропия идеального газа
- •10.8. Второе начало термодинамики
- •10.9. Статистическое толкование второго начала термодинамики
- •§11. Реальные газы
- •11.1. Уравнение Ван-дер-Ваальса
- •11.2. Критическое состояние вещества
- •11.3. Эффект Джоуля-Томсона
10.5. Адиабатический процесс
Наряду с изопроцессами существует адиабатический процесс, широко распространенный в природе. Адиабатическим процессомназываютпроцесс,протекающий без теплообмена с внешней средой. Это означает, что газ при адиабатическом процессе не получает извне тепла:dQ = 0. Первое начало термодинамики для моля газа будет иметь видdU = - dA . С учетом выражений (10.4) и (10.9) запишем последнее равенство в виде
Cv dT = -dA = - pdV . (10.14)
Если
при адиабатическом процессе газ
расширяется, то dA
![]() 0,dT
0,dT
![]() 0, т.е. внутренняя энергия газа
уменьшается, температура также
уменьшается, газ при адиабатическом
расширении охлаждается. При адиабатическом
сжатии газаdA
0, т.е. внутренняя энергия газа
уменьшается, температура также
уменьшается, газ при адиабатическом
расширении охлаждается. При адиабатическом
сжатии газаdA
![]() 0,dT
0,dT
![]() 0, его температура увеличивается.
Молекулярно-кинетическое объяснение
этого явления дано выше.
0, его температура увеличивается.
Молекулярно-кинетическое объяснение
этого явления дано выше.
Примером адиабатического процесса является распространение звуковых колебаний в воздухе. Сжатия и разряжения воздуха происходят так часто, что тепло не успевает переходить от слоев, имеющих большую температуру, к слоям с меньшей температурой. Следовательно, процессы, происходящие достаточно быстро, близки к адиабатическим.
Важное значение адиабатический процесс имеет в объяснении атмосферных явлений. Слои воздуха, поднимающиеся вверх, расширяются, так как атмосферное давление уменьшается с высотой. За счет расширения газ адиабатически охлаждается, поэтому с увеличением высоты температура газа уменьшается. Это объясняет и тот факт, что ветер, дующий с гор, всегда кажется теплым, так как воздух, перемещаясь, сжимается, а ветер, дующий с моря, кажется прохладным.
При адиабатическом процессе газ подчиняется уравнению Клапейрона pV = RT. Наличие дополнительного условия (10.14) позволяет уменьшить в этом уравнении число параметров состояния. Для этого выразимp из уравнения Клапейрона и подставим его в формулу (10.14):Cv dT = - RTdV /V . Разделяя переменные, получимdT/T +RdV/(VCv)= 0 .Взяв неопределенный интеграл, получим lnT +(R/Cv)lnV = const . В согласии с (10.10) и (10.13) получим(R/Cv) = 2/i = - 1 и с учетом последнего выражения lnT +( - 1)lnV = const. Потенцируя это равенство, придем к уравнению
TV-1 = const, (10.15)
где индекс опущен. Полученное соотношение представляет собой уравнение адиабаты в переменныхT и V. Чтобы от этого уравнения перейти к уравнению с переменнымиp и V , выразим из уравнения Клапейрона-Менделеева температуруT = mpV/R и подставим ее в выражение (10.15).
Получим
p

Соотношение (10.16) называют уравнением Пуассона. По форме это уравнение похоже на уравнение изотермы. Однако при увеличении объема для адиабатического процесса давление падает быстрее, чем для изотермического процесса (рис. 10.5).
Согласно выражению (10.14) работа для адиабатического процессаопределится по формуле
A= =
-
=
- =
С(T1- T2).
=
С(T1- T2).
С учетом выражения (10.10) получим для моля газа :
A= (i/2)R(T1- T2) = (i/2)(p1V1- p2V2).
Для произвольной массы газа m получимA =(i /2)(m /)(p1V1 - p2V2).
10.6. Круговые обратимые процессы. Цикл Карно
Механические процессы обладают замечательным свойством обратимости. Например, брошенный камень, описав некоторую траекторию, упал на землю. Если его бросить обратно с той же скоростью, то он опишет ту же траекторию, только в обратном направлении (трением пренебрегаем).
Совершенно иная ситуация имеет место в области тепловых явлений. Тепловой процесс, при котором проходятся те же тепловые состояния, но только в обратном порядке, как правило, невозможен. Например, необратимыми являются теплообмен при конечной разности температур между телами, процесс расширения газа в пустоту, а также выделение тепла при трении. Если произвольный тепловой процесс сопровождается перечисленными явлениями, то он необратим.
О

= A/Q1 =(Q1 - Q2)/Q1. (10.17)
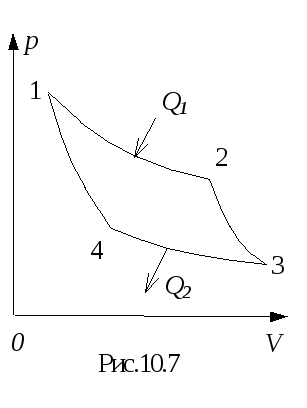
Для получения максимального КПД тепловой машины необходимо рассмотреть цикл, состоящий из обратимых процессов. Такой цикл, состоящий из двух изотерм и двух адиабат, рассмотрел французский инженер Сади Карно (рис.10.7). На участке цикла 1-2 газ получает от нагревателя тепло Q1 и, расширяясь изотермически от объемаV1 доV2 при температуреT1 , совершает для моля газа работу
A12 = Q1 = RT1 ln(V2 /V1). (10.18)
На участках 2-3 и 4-1 газ расширяется и сжимается адиабатически, не получая и не отдавая тепла. На участке 3-4 газ сжимают изотермически от объема V3 доV4 при температуреT2 , отнимая теплоQ2 . Работа, затрачиваемая на сжатие газа,
A34 = Q2 = RT2 ln(V3 /V4). (10.19)
Используя уравнение (10.15) для процессов 2-3 и 4-1, можно показать, что
V2 /V1 = V3 /V4 (10.20)
Подставляя выражения (10.18) и (10.19) в равенство (10.17) с учетом равенства (10.20), после сокращений получим
= (T1 - T2)/T1 . (10.21)
Видим, что КПД цикла
Карно определяется только температурами
нагревателя и холодильника. Например,
для паровой машины, имеющей T1
= 400К иT2 =300К, по
формуле (10.21) получим= 0,25. Реальный КПД паровых двигателей
вдвое меньше из-за потерь на трение и
т.д. Как показывается в курсах термодинамики,
КПД любого теплового двигателя не может
превосходить КПД цикла Карно, работающего
между теми же температурными интервалами,
т.е.реал![]() (T1 - T2)/T1
. Из формулы (10.21) следует, что для
увеличения КПД теплового двигателя
необходимо увеличивать температуру
нагревателя. Именно поэтому КПД двигателей
внутреннего сгорания значительно выше,
чем паровых.
(T1 - T2)/T1
. Из формулы (10.21) следует, что для
увеличения КПД теплового двигателя
необходимо увеличивать температуру
нагревателя. Именно поэтому КПД двигателей
внутреннего сгорания значительно выше,
чем паровых.
|
ЛЕКЦИЯ 16 |
