
- •§1. Несколько вводных замечаний о предмете физики.
- •§2. Механика
- •2.2. Кинематика движения материальной точки. Характеристики движения.
- •2.3. Вектор скорости. Средняя и мгновенная скорость.
- •2.4. Путь при неравномерном движении.
- •2.6. Криволинейное движение.
- •2.6.1. Ускорение при криволинейном движении (тангенциальное и нормальное ускорение).
- •2.7. Кинематика вращательного движения.
- •2.7.1. Угловая скорость.
- •2.7.2. Угловое ускорение.
- •2.7.3. Связь между линейной и угловой скоростью.
- •§3. Динамика
- •3.2. IIзакон Ньютона.
- •3.3. IiIзакон Ньютона.
- •3.4. Импульс. Закон сохранения импульса.
- •3.5. Работа и энергия.
- •3.6. Мощность.
- •3.7. Энергия.
- •3.8. Кинетическая энергия тела.
- •3.9. Потенциальное поле сил. Силы консервативные и неконсервативные.
- •3.10. Потенциальная энергия тела в поле сил тяжести (в поле тяготения Земли).
- •3.11. Потенциальная энергия в гравитационном поле (в поле всемирного тяготения).
- •3.12. Потенциальная энергия упруго деформированного тела.
- •3.13. Закон сохранения энергии.
- •§4. Механика твердого тела.
- •4.1. Поступательное движение твердого тела.
- •4.2. Вращательное движение твердого тела.
- •4.3. Момент импульса тела.
- •4.4. Закон сохранения момента импульса.
- •4.5. Основное уравнение динамики вращательного движения.
- •4.6. Кинетическая энергия вращающегося твердого тела.
- •4.7. Работа внешних сил при вращательном движении твердого тела.
- •§5. Гидродинамика
- •5.1. Линии и трубки тока.
- •5.2. Уравнение Бернулли.
- •5.3. Силы внутреннего трения.
- •5.4. Ламинарное и турбулентное течения.
- •5.5. Течение жидкости в круглой трубе.
- •5.6. Движение тел в жидкостях и газах.
- •§6. Всемирное тяготение.
- •6.1. Законы Кеплера.
- •6.2. Опыт Кавендиша.
- •6.3. Напряженность гравитационного поля. Потенциал гравитационного поля.
- •§7. Основы теории относительности.
- •7.1. Принцип относительности.
- •7.2. Постулаты специальной (частной) теории относительности. Преобразования Лоренца
- •7.3. Следствия из преобразований Лоренца.
- •7.4. Интервал между событиями.
- •§8. Колебания.
- •8.1. Общие сведения.
- •8.2. Уравнение гармонического колебательного движения.
- •8.3. Графическое изображение гармонических колебаний. Векторная диаграмма.
- •8.4. Скорость, ускорение и энергия колеблющегося тела.
- •8.5. Гармонический осциллятор.
- •8.6. Малые колебания системы вблизи положения равновесия.
- •8.7. Математический маятник.
- •8.8. Физический маятник.
- •8.9. Затухающие колебания.
- •8.10. Вынужденные колебания. Резонанс.
- •Молекулярная физика и термодинамика §9. Молекулярная физика
- •9.1. Предмет и методы молекулярной физики.
- •9.2. Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние.
- •9.2.1. Идеальный газ. Параметры состояния идеального газа.
- •9.2.2. Газовые законы.
- •9.2.3. Закон Авогадро.
- •9.2.4. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона).
- •Физический смысл универсальной газовой постоянной.
- •9.2. Основное уравнение кинетической теории газов
- •9.3. Барометрическая формула. Распределение Больцмана
- •9.4. Максвелловское распределение молекул по скоростям
- •9.5. Явления переноса. Длина свободного пробега молекул
- •9.6. Явление диффузии
- •9.7. Явление теплопроводности и вязкости
- •§10. Термодинамика
- •10.1. Внутренняя энергия идеального газа
- •10.2. Работа и теплота. Первое начало термодинамики
- •10.3. Работа газовых изопроцессов
- •10.4. Молекулярно-кинетическая теория теплоемкостей
- •10.5. Адиабатический процесс
- •10.6. Круговые обратимые процессы. Цикл Карно
- •10.7. Понятие об энтропии. Энтропия идеального газа
- •10.8. Второе начало термодинамики
- •10.9. Статистическое толкование второго начала термодинамики
- •§11. Реальные газы
- •11.1. Уравнение Ван-дер-Ваальса
- •11.2. Критическое состояние вещества
- •11.3. Эффект Джоуля-Томсона
9.2.3. Закон Авогадро.
На основании опытов с различными газами итальянский ученый Авогадро в 1811г. установил следующий закон:
ОПРЕДЕЛЕНИЕ: При одинаковых температуре и давлении киломоли любых газов занимают одинаковые объемы. При нормальных условиях (t=0C,P=1атм) объем киломоля любого газа составляет 22,4м3/кмоль.
9.2.4. Уравнение состояния идеального газа (уравнение Менделеева Клапейрона).
Д о
этого рассматривались газовые процессы,
при которых один из параметров состояния
газа оставался неизменным, а два других
изменялись. Теперь рассмотрим общий
случай, когда изменяются все три параметра
состояния газа и получим уравнение,
связывающее все эти параметры. Закон,
описывающий такого рода процессы, был
установлен в 1834г. Клапейроном (французский
физик, с 1830г. работал в Петербургском
институте путей сообщения) путем
объединения рассмотренных выше законов.
о
этого рассматривались газовые процессы,
при которых один из параметров состояния
газа оставался неизменным, а два других
изменялись. Теперь рассмотрим общий
случай, когда изменяются все три параметра
состояния газа и получим уравнение,
связывающее все эти параметры. Закон,
описывающий такого рода процессы, был
установлен в 1834г. Клапейроном (французский
физик, с 1830г. работал в Петербургском
институте путей сообщения) путем
объединения рассмотренных выше законов.
Пусть имеется некоторый газ массой “m”. На диаграмме (P,V) рассмотрим два его произвольных состояния, определяемых значениями параметровP1,V1,T1иP2,V2,T2. Из состояния 1 в состояние 2 будем переводить газ двумя процессами:
1. изотермического расширения (11);
2. изохорического охлаждения (12).
Первый этап процесса описывается законом Бойля-Мариотта, поэтому
![]() . (9.5)
. (9.5)
Второй этап процесса описывается законом Гей-Люссака:
 . (9.6)
. (9.6)
Исключая из этих
уравнений
![]() ,
получим:
,
получим:
 . (9.7)
. (9.7)
Поскольку состояния 1 и 2 были взяты совершенно произвольно, то можно утверждать, что для любого состояния:
|
|
– уравнение Клапейрона |
где С – постоянная для данной массы газа величина.
Недостатком этого уравнения является то, что величина “C” различна для различных газов, Для устранения этого недостатка Менделеев в 1875г. несколько видоизменил закон Клапейрона, объединив его с законом Авогадро.
Запишем полученное уравнение для объема Vкм.одного 1 киломоля газа, обозначив постоянную буквой “R”:
![]() .
.
Согласно закону Авогадро при одинаковых значениях PиTкиломоли всех газов будут иметь одинаковые объемыVкм.и, следовательно, постоянная “R” будет одинакова для всех газов.
Постоянная
“R”называется универсальной
газовой постоянной. Полученное уравнение![]() связывает параметрыкиломоляидеального газа и, следовательно,
представляет уравнение состояния
идеального газа.
связывает параметрыкиломоляидеального газа и, следовательно,
представляет уравнение состояния
идеального газа.
Значение постоянной “R” можно вычислить:
 .
.
От уравнения для 1кмоль легко перейти к уравнению для любой массы газа “m”, приняв во внимание, что при одинаковых давлениях и температуре “z” киломолей газа будут занимать в ”z” раз больший объем, чем 1 кмоль.(V=zVкм.).
С другой
стороны отношение
![]() ,
гдеm– масса газа,– масса 1 кмоля, будет определять число
молей газа.
,
гдеm– масса газа,– масса 1 кмоля, будет определять число
молей газа.
Умножим
обе части уравнения Клапейрона на
величину
![]() ,
получим
,
получим

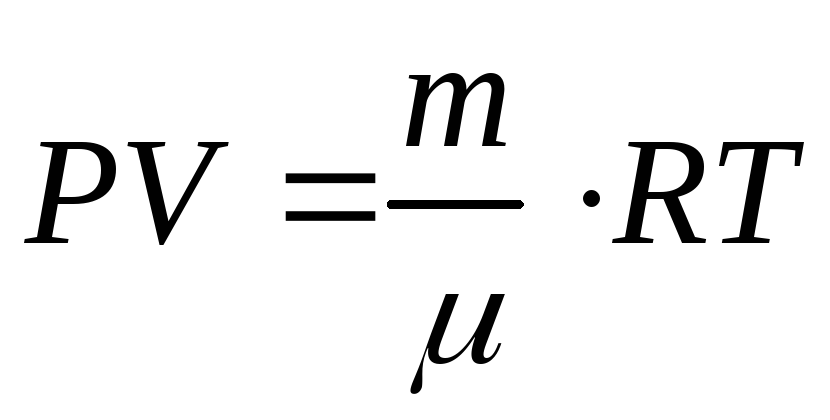 (9.7а)
(9.7а)
Это и есть уравнение состояния идеального газа, записанное для любой массы газа.
Уравнению
 можно придать другой вид. Для этого
введем величину
можно придать другой вид. Для этого
введем величину
 ,
,
где R– универсальная газовая постоянная;
NA– число Авогадро;
k– постоянная Больцмана (далее будет показано, что “k” представляет коэффициент пропорциональности между средней энергией теплового движения молекулы и абсолютной температурой).
Подстановка числовых значений RиNAдает следующее значение:
 .
.
Умножим и разделим
правую часть уравнения
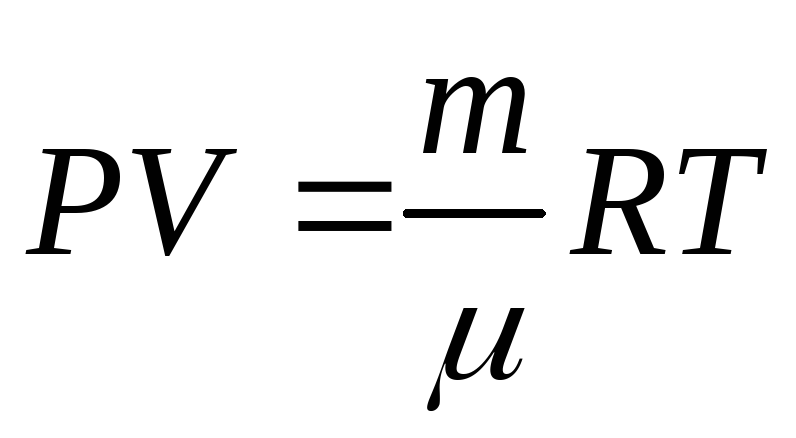 наNA,
тогда
наNA,
тогда![]() ,
здесь
,
здесь![]() – число молекул в массе газа “m”.
– число молекул в массе газа “m”.
С учетом этого
![]() (*)
(*)
Вводя величину
![]() – число молекул в единице объема,
приходим к формуле:
– число молекул в единице объема,
приходим к формуле:
![]() (**)
(**)
Уравнения (*) и (**) представляют различные формы записи уравнения состояния идеального газа.
Отношение
![]() ,
тогда плотность идеального газа можно
получить из уравнения
,
тогда плотность идеального газа можно
получить из уравнения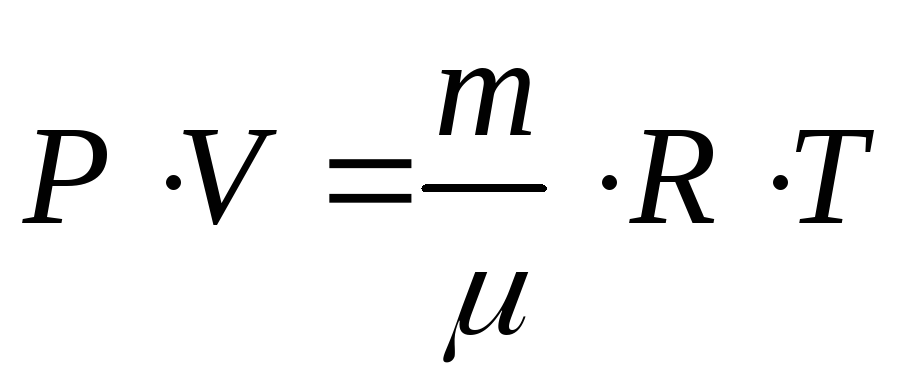 .
.
![]()
![]()
![]() .
.
Таким образом, плотность идеального газа пропорциональна давлению и обратно пропорциональна температуре.
Простая связь между температурой и остальными параметрами идеального газа делает заманчивым его использование в качестве термометрического вещества. Обеспечив постоянство объема и использовав в качестве температурного признака давление газа, можно получить термометр с идеальной линейной температурной шкалой. Эту шкалу будем называть идеальной газовой шкалой температур.
Практически, по международному соглашению, в качестве термометрического тела берут водород. Установленная по водороду с использованием уравнения состояния идеального газа шкала называетсяэмпирической шкалой температур.
