тальная часть противоионов составляет диффузный слой, в кото ром концентрация ионов (по мере удаления от поверхности коллоидной частицы) постепенно убывает.
Неподвижный адсорбционный слой содержит далеко не все противо ионы, а лишь определенную их часть, которая не в состоянии цели ком компенсировать заряд твердой поверхности, а способна лишь его понизить. Иными словами, в адсорбционном неподвижном слое в ре зультате взаимодействия положительных и отрицательных зарядов остается ненейтрализованным некоторый потенциал, который являет ся частью общего потенциала поверхности твердой фазы.
Рис. 168. Схема двойного электрического слоя:
о — расположение зарядов; 6 — кривая падения потенциала
Разность потенциалов между подвижной (диффузной) и неподвиж ной (адсорбционной) частью двойного электрического слоя называет ся электрокинетическим потенциалом. Этот потенциал обычно обозна чают греческой буквой g (дзета) и потому называют дзета-потенциа лом (g-потенциал).
Полное падение потенциала от его значения на поверхности MN до нулевого значения (рис. 168, б) соответствует максимальной раз ности потенциалов между твердой поверхностью и всеми противоио нами, вместе взятыми. Эту максимальную разность потенциалов назы вают термодинамическимt потенциалом и обозначают греческой бук вой е (эпсилон).
Как видно из рис. 168, б, электрокинетический потенциал состав ляет лишь часть термодинамического потенциала е:
£= е—8х,
где ех — падение потенциала в неподвижном слое, вызываемое налич ными в нем адсорбированными противоионами.
Вычисление электрокинетического потенциала и определение его знака на практике производят, пользуясь данными электрофореза п электроосмоса, а также из потенциалов течения, по следующей фор муле:
Кт\и
где К — постоянная, зависящая от формы коллоидно-дисперсных ча стиц (для малых сферических частиц К = 6, для частиц цилиндриче ской формы К = 4); 11 — вязкость дисперсионной среды, D — диэлек трическая постоянная, е — градиент напряжения поля, и — средняя скорость передвижения частиц под действием электрического поля.
Рис. 169. Падение электри ческих потенциалов ми целлы:
ОА — максимальный электро динамический потенциал на по верхности ядра мицеллы; АВ — падение потенциала в адсорб ционном слое; DB — электрокинетический потенциал (£*гтотенциал) на поверхности грану
лы; ВС — падение |
потенциала |
в диффузном |
слое |
Как видно на рис. 169, величина дзета-потенциала тесно связана g толщиной диффузного слоя противоионов. Обычно чем больше раз мыт этот слой, тем больше величина потенциала. Если слой противо ионов предельно сжат, т. е. вовсе не размыт, дзета-потенциал равен нулю. Дзета-потенциал определяется толщиной диффузного слоя противоинов, следовательно, его величина находится в обратной зави симости от концентрации электролитов, присутствующих в растворе. Увеличение концентрации электролитов влечет за собой уменьшение толщины диффузного слоя и, как следствие, уменьшение дзета-потен циала. Согласно закону действия масс повышение концентрации элек тролита способствует понижению концентрации противоионов в диффузном слое. При этом часть противоинов переходит из диффуз ного в адсорбционный слой, в результате дзета-потенциал уменьшается. Наоборот, разбавление золя способствует увеличению толщины диф фузного слоя за счет перехода противоионов из адсорбционного слоя. Таким образом, дзета-потенциал очень чувствителен к посторонним электролитам. Причем, влияние на него оказывают и ионы, имеющие заряд обратного знака.
Влияние постороннего иона на величину дзета-потенциала тем сильнее, чем больше заряд иона.
Как показали многочисленные опыты, влияние природы иона на дзета-потенциал возрастает в гораздо большей степени, чем заряд ио нов. Так, для ионов К+, Ва2+, А13+заряды относятся, как 1: 2 :3, а кон
центрации, *производящие одинаковое действие, относятся, как
800 : 25 : 1.
Знак электрокинетического или дзета-потенциала зависит от химической природы твердой фазы. Кислые вещества (кремниевая кис лота, мастика, таннин, сульфиды металлов, сера) в водном растворе имеют, как правило, отрицательный заряд.
Особенно ясно выступает зависимость знака дзета-потенциала твердой фазы от ее химического характера при рассмотрении групп кислотного (карбоксильные) и основного (амины) характера.
§ 112. Мицеллярная теория строения коллоидной частицы
Советские ученые А. В. Думанский, Н. Н. Песков, С. М. Липа тов, А. Н. Фрумкин, а также зарубежные ученые Веймарн, Паули, Фаянс, Кройт на основе теории двойного электрического слоя создали так называемую мицеллярную теорию строения коллоидных частиц. Первоначально представление о мицеллярном строении частиц рас пространялось на все системы, изучаемые коллоидной химией, в том числе и на лиофильные золи. Однако последующие исследования по казали, что лиофильные золи, или, точнее, растворы высокомолекуляр ных и высокополимерных соединений, - имеют другое, весьма отлич ное от лиофобных золей строение. В 'настоящее время мицеллярная теория строения коллоидных частиц сохраняет свое значение только для лиофобных (гидрофобных) золей.
Всякий лиофобный (гидрофобный) коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидкости. Мицеллы — это отдельное коллоидные частицы, которые в совокупности составля ют дисперсную фазу золя, а интермицеллярная жидкость — это дис персионная среда того же золя, включающая в себя, помимо среды-рас творителя, все другие растворенные в ней вещества (электролиты и не электролиты), которые непосредственно не входят в состав мицелл.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутрен нюю — нейтральную, обычно называемую ядром, и внешнюю — ионо генную, в свою очередь состоящую из двух слоев (двух ионных сфер).
Я д р о составляет основную массу коллоидной мицеллы и пред ставляет собой комплекс, состоящий из атомов (в случае гидрозолей металлов или неметаллов) или нейтральных молекул (в золях гидро ксида железа (III) или иодида серебра). Общее число входящих в со став ядра атомов или молекул огромно (от нескольких сот до миллио нов) и зависит от степени дисперсности золя и от размеров самих ато мов или молекул.
На первом этапе развития коллоидной химии считали, что коллоид ные частицы имеют аморфную природу. Однако рентгенографические исследования доказали (как в свое время указывал И. Г. Борщев) кри тическое строение ядра мицеллы.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого
адсорбционного слоя из ионов стабилизатора. Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев (или двух сфер) — адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проник ших за плоскость скольжения и наиболее прочно связанных электро статическими силами притяжения. Вместе с ядром эта ионная атмо сфера образует как бы отдельный гигантских размеров многозарядный ион — катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбцион ного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоинов, общее число которых равняется в сред нем разности между всем числом потенциалопределяющих ионов и чис лом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоинов составляет кол лоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ио ны тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси.
Для примера рассмотрим получение гидрозоля иодида серебра ме тодом конденсации. Оно основано на химической реакции
AgN03 + K I=A gI + KN03
Согласно теории строения коллоидной мицеллы ядро в данном слу чае будет состоять из нейтральных молекул Agl. В зависимости от от носительной концентрации реагирующих веществ может быть три случая.
1. Концентрация нитрата серебра больше концентрации иодида калия. При этом в системе, помимо нерастворимого комплекса Agl име ются ионы Ag+, К+ и N0 з- В процессе роста ядра коллоидной мицеллы достраивание решетки Agl идет только за счет ионов Ag+, которые прочно входят в его структуру, сообщают ему электрический заряд и потому называются потенциалопределяющими. Полученный в резуль тате адсорбции ионов Ag+ электрический заряд определяет термодина мический потенциал.
Положительно заряженное ядро притягивает оставшиеся в раство ре противоионы N 03. Часть противоинов при этом входит в состав адсорбционного слоя, оставшаяся часть — в состав диффу’зного слоя. На рис. 170 изображена схема постепенного образования мицеллы ги дрозоля Agl.
2.Концентрация нитрата серебра меньше концентрации иодида калия. В этом случае поверхность ядра адсорбирует только анион I- , который входит в его структуру и определяет знак заряда.
3.Концентрации нитрата серебра и иодида калия равны. В этом случае золь находится в так называемом изоэлектрическом состоянии, т. е. в состоянии, при котором электрокинетический потенциал (дзетапотенциал) равен нулю. В этом случае противоины диффузного слоя перешли в адсорбционный слой, а потому гранула лишена заряда.
—403 -
/
/
Рис. 170. Схема постепенного образования мицеллы гидро золя Aql:
о — ультрамикрокристалл Agl; б — достраивание ультрамикрокристал ла ядра за счет избирательной адсорбции из раствора ионов Ag+ (ста дия образования адсорбционного слоя); в — образование гранулы (за вершение образования адсорбционного слоя); г — образование мицеллы
Строение мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. Так, в обобщенном и упрощенном виде стро ение любой мицеллы гидрофобного золя можно передать следующими формулами:
{т [ядро] яК+ (п—х) А- )+ хА
положительно заряженная мицелла,
{т [ядро] пА~ (п — х) К +]" *К+
отрицательно заряженная мицелла, где К+ — катионы, А~ — анионы, п — число потенциалопределяющих
ионов, х — число ионов, находящихся в диффузном слое, т — число нейтральных атомов или молекул в ядре.
В этих формулах в квадратные скобки заключено ядро, а в фигур ные — заряженный комплекс (гранула).
Мицеллярная формула иодида серебра для первого случая (когда Cakno, > Cju) примет вид:
{от [Agl] nAg+ (п — х)} + *NO~
Во втором случае (когда C a s n o , <С С ю) формула запишется так:
{от [Agl] n l - (п — х) К+}- хК+
В третьем случае, когда концентрации обоих электролитов равны, ми целлярная формула будет иметь вид:
{ от [Agl] nAg+ nNOj"J°
Рассмотрим примеры образования и строения мицелл различных золей.
Подвергая гидролизу разбавленный раствор FeCls, можно получить коллоидный раствор гидроксида железа (III). Реакция гидролиза про текает по уравнению
FeCl3 + ЗНгО = Fe (ОН)3 + ЗНС1
Ионным стабилизатором здесь является FeOCI, образующаяся по уравнению:
Fe (ОН)3 + HCI = FeOCI + 2НгО
Молекула стабилизатора диссоциирует по уравнению
FeOCI ji± F e O + + Cl-
Таким образом, ядро коллоидной мицеллы гидроксида железа Fe(OH)3 состоит из большого числа молекул Fe(OH)3. Потенциалопределяющим ионом является FeO+, так как ион С1~ не входит в состав ядра. Исходя из этого мицеллярная формула золя гидроксида железа (III) может быть изображена следующим образом:
{от [Fe (ОН)3[ «FeO+ (п — х) С1~}+ *С1-
На рис. 171 приведено схематическое изображение мицеллы гидро ксида железа (III).
Золь кремниевой кислоты относится к группе отрицательно заря женных золей. Ядро мицеллы состоит из скопления молекул кремни евой кислоты, часть которых, находящаяся на поверхности ядра, дис социирует на ионы по уравнению
H2Si03 2Н+ + SiO^-
причем ионы SiO!- , как прочно связанные с ядром, являются потенциалопределяющими. Роль компенсирующих ионов (противоионов) выполняют ионы водорода, которые распределяются как в адсорбцион ном, так и в диффузном слоях. Схематически строение коллоидной ми целлы этого золя можно изобразить формулой:
{от [H2Si03] nSi03—2 (п —х) Н+} ~2*Н+
На рис. 172 определена схема строения мицеллы золя кремниевой кис лоты.
В табл. 79 указан знак заряда |
мицеллярного остова (гранулы) |
в гидрозолях различных веществ. |
|
|
Т а б л и ц а 79 |
Знак заряда мицеллярного остова в гидрозолях различных веществ |
Золи, заряженные положительно |
Золи, заряженные отрицательно |
Гидроксиды: железа, кадмия, алю миния, хрома, церия, циркония, то рия титана. Титановая кислота.
Основные красители: метиленовая синь, метиленовая фиолетовая, ноч ная голубая и др.
Золото, серебро, платина, сера. Суль фиды: мышьяка, меди, сурьмы, свинца, кадмия.
Кислоты: кремниевая, оловянная. Пятиокись ванадия. Мастика, гумми
арабик. Крахмал, пектин, танин. Кис лые красители: эозин, фуксин, бензо пурпурин, красное конго и др.
Рассмотренная выше мицеллярная теория строения гидрофобных коллоидов дает возможность наглядно представить схему движения гранулы и противоионов при электрофорезе. На рис. 173 дана такая схема для положительно заряженных золей.
Рис. 173. Схема электрофореза:
а — мицелла вне |
электрического |
поля; |
б — мицелла |
в |
электрическом |
поле |
|
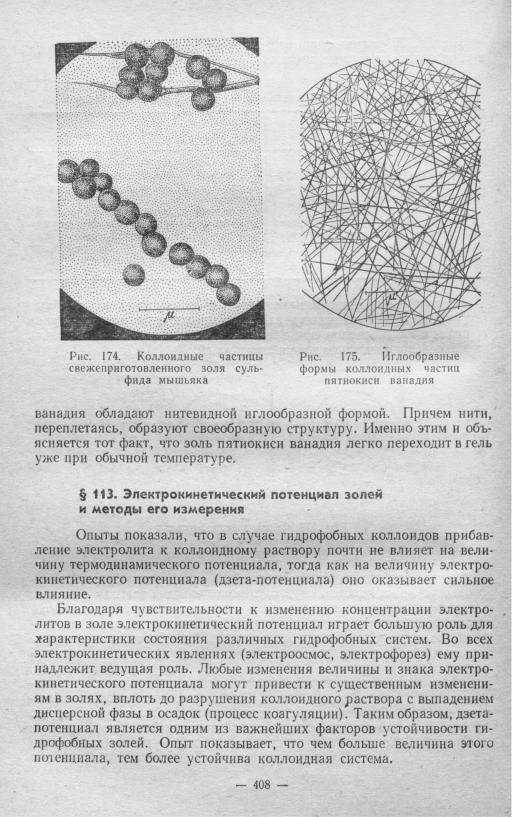
Форма коллоидных частиц может быть самой разнообразной. Изу чение строения и процесса образования коллоидных частиц с помощью электронного микроскопа позволило установить, что их форма во мно гом определяется типом кристаллической решетки ядра, которую обра зуют входящие в него атомы и молекулы. В зависимости от природы вещества решетка может быть как симметричной, так и асиммет ричной.
От формы частиц дисперсной фазы зависят некоторые свойства кол лоидных растворов. Так, коллоидные системы асимметрического строе ния способны образовать внутреннюю сетчатую структуру. На рис. 174 и 175 приведены полученные на электронном микроскопе снимки коллоидных частиц свежеприготовленного золя сульфида мышьяка и пятиокиси ванадия. Как видно из этих рисунков, частицы пятиокиси
Экспериментально определяют величину электрокинетического потенциала методом электрофореза или методом электроосмоса.
Сущность первого метода заключается в непосредственном измерении ско рости передвижения коллоидных частиц под действием постоянного электриче ского поля в специальном приборе — электрофоретической трубке. На рис. 176 показан один из наиболее простых электрофоретических приборов. Стеклянная трубка аппарата на всем протяжении и в кранах А и А { имеет совершенно одина ковый просвет. Фигурно изогнутые концы трубки служат для погружения агаро вых сифонов присоединяемых к источнику электричества через промежуточные сосуды.
Исследуемый золь наливают в аппарат при открытых кранах А и Ах в таком количестве, чтобы его уровень оказался выше кранов. Затем краны закрывают и жидкость, оставшуюся выше кранов, удаляют. Далее поверх кранов (остающих ся закрытыми) наливают так называемую надстилающую жидкость (обычно ульт рафильтрат того же самого золя). Открыв кран В, автоматически получают оди наковый уровень жидкости в обоих коленах трубки. Перед тем как включить ток, кран В закрывают, а краны А и А1 открывают. Передвижение дисперсной фазы исследуемого золя измеряют по миллиметровой шкале, нанесенной прямо на труб ке. Зная время действия и величину приложенной разности потенциалов, а так же расстояние между электродами и смещение дисперсной фазы, получают ско рость перемещения, рассчитанную на падение потенциала в 1 в!см.
Величину электрокинетического потенциала вычисляют по формуле (X, I).
Выражая дзета-потенциал в милливольтах, е — в вольтах |
на 1 см, D — в мил |
ликулонах в секунду и К = 4, получим |
|
£=l,1295-104 -jj'. |
(X,2) |
Опыт показывает, что величина электрокинетического потенциала, рассчитанная по формулам (X, 1) или (X, 2), для большинства гидрофобных золей составляет около 30—40 мв. Однако имеются и высокозаряженные золи с величиной потен циала 60—70 мв.
Согласно уравнению (X, 1) отношение XJu не зависит от размера коллоидных мицелл, однако это справедливо в том случае, если размер частиц велик по сравнению с толщиной двойного электрического слоя. Для подавляющего боль шинства гидрофобных золей это условие выполняется. Совершенно иную карти ну наблюдаем в случае высокомолекулярных соединений, например белка, ра диус молекул которого сравним с толщиной двойного слоя. В этом слое электро форетическая подвижность зависит, как показывает опыт, не только от формы, но и от размеров коллоидно-дисперсных частиц.
Метод определения величины и знака электрокинетического потенциала на ос нове электроосмотических явлений применяется преимущественно для исследова ния материалов, которые трудно (или невозможно) получить в растворенном или высокодисперсном состоянии. На рис. 177 изображен прибор Гортикова для электроосмоса, широко применяемый для определения величины и знака почвен ных коллоидов. На дно пробирки помещают почву и уплотняют ее на центрифуге. Перед уплотнением в пробирку с почвой наливают воду или почвенный раствор, затем закрывают ее резиновой пробкой, через которую проходит стеклянная труб ка, доходящая до самого дна пробирки. После уплотнения на центрифуге через второе отверстие в пробку вставляют еще одну трубку, конец которой находится над образцом почвы. Каждая из трубок имеет по два отростка: длинный отросток заполняется агар-агаром, приготовленным на насыщенном растворе КС1; корот кий представляет собой капиллярную трубку. В ней и наблюдают движение ме ниска жидкости, которое объясняется скольжением жидкой фазы коллоидной системы на границе коллоидной гранулы и диффузного слоя.
Длинные отростки трубок опускают вместе с электродами в стаканчики с раст вором соли, затем электроды соединяют с источником постоянного тока. Чем боль ше заряд почвенных коллоидов, тем быстрее передвигается жидкость в капилляр ных трубках. Скорость передвижения жидкости (объем жидкости,перенесенный в секунду) тем больше, чем выше величина дзета-потенциала почвенных коллои-