
колок
.docxИонометрия
Потенциометрические методы анализа (прямая потенциометрия) основаны на измерении равновесного потенциала и использовании зависимости между равновесным потенциалом и активностью (концентрацией) определяемого компонента в растворе. Аналитическим сигналом в потенциометрии является потенциал индикаторного электрода, измеренный относительно электрода сравнения. В действительности измеряют ЭДС гальванического элемента. В потенциометрии электрохимическая ячейка является гальваническим элементом, состоящим из двух электродов, потенциал которых обратимо изменяется в зависимости от состава раствора. Измерения необходимо проводить в условиях, близких к равновесным, т.е. в отсутствие тока во внешней цепи.
Металлические электроды, потенциал которых зависит от активности (концентрации) собственных ионов в растворе, называют электродами первого рода. Лишь для некоторых металлов устанавливается потенциал, являющийся функцией активности соответствующих ионов, описываемый уравнением Нернста. На поверхности ряда металлов образуется оксидная пленка. Сами металлы и оксидная пленка могут взаимодействовать с компонентами исследуемого раствора (ионами Н3О+ , ОН− , ионами благородных металлов, окислителями и восстановителями других систем). По этим причинам большинство металлов не может быть использовано для определения активности (концентрации) собственных ионов. Электроды из благородных металлов являются лишь переносчиками электронов от восстановленной формы к окисленной, и обратно. Для обратимых окислительно-восстановительных систем их потенциалы являются функцией отношения активностей окисленной и восстановленной форм системы. Электроды из платины (и золота) используют при потенциометрическом окислительно-восстановительном титровании
В настоящее время в качестве электродов сравнения в потенциометрии используют преимущественно электроды второго рода — хлоридсеребряный и каломельный, обратимые относительно аниона.
Потенциал индикаторного электрода измеряют по отношению к электроду, потенциал которого должен быть постоянным; этот электрод называют электродом сравнения. Строго говоря, совсем необязательно знать значение потенциала электрода сравнения. Основные требования к электроду сравнения следующие: потенциал электрода сравнения должен быть воспроизводим при измерениях и не должен существенно изменяться при протекании через него небольших токов; состав анализируемого раствора не должен влиять на потенциал электрода сравнения.
Индикаторный электрод — это электрод гальванической ячейки, который обратимо реагирует на изменение активности (концентрации) определяемого компонента в растворе. В качестве индикаторных электродов в потенциометрических методах анализа применяют металлические и мембранные ионоселективные электроды.
Ионоселективным электродом называют электрохимический датчик на основе мембраны, потенциал которой линейно зависит от логарифма активности определяемого иона в растворе. Ионоселективные электроды наиболее широкое применение находят в потенциометрии. Основной частью таких электродов является проницаемая для одного из ионов (полупроницаемая) мембрана. Мембраны ионоселективных электродов представляют собой тонкую пленку растворов электролитов, твердый или стеклообразный электролит.
Селективность электрода определяется его способностью реагировать на изменение активности (концентрации) определенных ионов. Чем меньше влияют посторонние вещества на потенциал ионоселективного электрода, тем более селективным этот электрод является.
Уравнение
Нернста:
![]()
а(… ) — активность ионов
E…/… − ° — стандартный электродный потенциал.
При
потенциометрических измерениях с
использованием ионоселективных
электродов часто измеряют ЭДС ячейки:

Отметим,
что мембрана ионоселективного электрода
контактирует с растворами, содержащими
определяемый ион. Активность (и
концентрация) этого иона (а1) во внутреннем
растворе 1 постоянна. Тогда для потенциала
ионоселективного электрода (Еи.с.э)
справедливо следующее уравнение:
![]()
где k — постоянная, объединяющая все величины, независящие от активности ai определяемого i-го иона в анализируемом растворе; знак «+» или «−» определяется знаком заряда i-го иона; zi — заряд i-го иона; Eдиф — диффузионный потенциал на границе раздела анализируемый раствор— электролит внешнего электрода сравнения, зависящий от состава и концентрации раствора, а также от подвижности соответствующих ионов.

где zi — заряд основного (потенциалопределяющего) иона; ai , аВ, аС — активности определяемого (i) и посторонних (В, С, … ) ионов соответственно; Кi/В, Кi/С — потенциометрические коэффициенты селективности; zВ, zС — заряды посторонних ионов.
Время отклика — это время достижения стационарного потенциала от момента погружения электрода в раствор.
Обычно крутизна электродной функции составляет (при температуре 25 °С) для однозарядных ионов 53— 58 мВ, для двухзарядных ионов 25— 28 мВ.
Ионная сила раствора влияет на коэффициенты активности анализируемых ионов, а также на диффузионный потенциал (потенциал жидкостного соединения). Поэтому ионную силу всех растворов для данной серии измерений необходимо поддерживать постоянной в диапазоне от 0,1 до 2,0 моль/л.
Для кристаллических мембран характерна высокая селективность. Мешающее действие посторонних веществ для таких мембран связано с образованием новых фаз на их поверхности.
Ионометрия — это прямой экспрессный метод анализа, однако для получения правильных и воспроизводимых результатов измерений необходимы определенные условия
Как правило,
ионометрию используют для определения
концентраций, а не активностей ионов в
растворе. Учитывая, что диффузионный
потенциал и ионная сила в серии измерений
постоянны, а следовательно постоянен
коэффициент активности определяемого
иона, уравнение для ионоселективного
электрода можно выразить следующим
образом:
![]()
где С(М) — концентрация определяемого иона М; S — крутизна графика электродной функции.
Полярография
Амперометрическое титрование В процессе развития полярографического (вольтамперометрического) метода был разработан физико-химический метод титриметрического анализа, названный методом амперометрического титрования. Он основан на измерении предельного (диффузионного) тока, изменяющегося при титровании вследствие изменения концентрации определяемого вещества или титранта. Амперометрическое титрование может быть осуществлено в том случае, если хотя бы один из компонентов химической реакции окисляется или восстанавливается на микроэлектроде в доступной области потенциалов, т.е. является электрохимически активным. Протекающий через электролитическую ячейку предельный (диффузионный) ток при определенном значении потенциала микроэлектрода является параметром, по изменению которого следят за ходом титрования. В связи с этим амперометрическое титрование, с одной стороны, является вариантом вольтамперометрии, а с другой стороны — титриметрическим методом.
В полярографии к анализируемому раствору добавляют электролит, не принимающий участия в электродной реакции, так называемый индифферентный электролит (или фон). Добавление фона обеспечивает сравнительно низкое (200— 400 Ом) сопротивление раствора. При силе тока 10−7— 10−5 А, которая обычно используется при измерениях, значение IR мало и им можно пренебречь. Потенциал электрода сравнения (макроэлектрода) остается постоянным при прохождении малого тока. Поскольку поляризация анода мала, приложенное к ячейке напряжение равно потенциалу ртутного капающего электрода, т.е. U = −Ek, если индикаторный электрод является катодом.
Кулонометрические методы анализа
Кулонометрические
методы анализа основаны на измерении
количества электричества, израсходованного
на электропревращение определяемого
вещества. Связь между массой вещества,
подвергнутого электропревращению
(электролизу), и затраченным при этом
количеством электричества определяется
законом Фарадея:
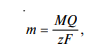
В отличие от большинства современных физических и физико-химич
еских методов анализа кулонометрия является безэталонным методом.
кулонометрические методы анализа обеспечивают получение результатов с лучшей воспроизводимостью, чем большинство других методов анализа при определении как малых, так и сравнительно больших концентраций; они более экспрессны и легко автоматизируются. В зависимости от происходящих электродных процессов кулонометрические методы подразделяют на прямую кулонометрию и косвенную кулонометрию (кулонометрическое титрование). В случае прямой кулонометрии определяемое вещество непосредственно подвергается электролизу (электрохимическому превращению). При косвенной кулонометрии (кулонометрическом титровании) при электролизе вспомогательного реагента получают (генерируют) титрант, вступающий в химическую реакцию с определяемым веществом. Зная количество электричества, израсходованное на получение титранта, рассчитывают массу определяемого компонента. При этом не имеет значения, является ли определяемое вещество электрохимически активным.
Кулонометрические определения можно осуществлять, задавая (контролируя) либо потенциал рабочего электрода, либо силу тока электролиза. В соответствии с контролируемым параметром кулонометрические методы разделяют на две группы:
1) потенциостатические, в которых потенциал рабочего электрода остается неизменным в течение всего времени электролиза;
2) гальваностатические (амперостатические), в которых сила тока в течение всего времени электролиза поддерживается постоянной.
При использовании кулонометрического метода анализа необходимо выполнение определенных условий. Прежде всего электролиз должен осуществляться со 100%-м выходом по току. Следовательно, количество электричества должно полностью расходоваться на основную электродную реакцию. Выход по току менее 100 % может быть обусловлен затратами электричества на такие побочные электродные процессы, как электролиз растворителя, восстановление или окисление примесей или реакции с участием материала электрода, а также на протекание вторичных электродных реакций окисления или восстановления первоначально полученных продуктов электролиза.
Косвенная кулонометрия (кулонометрическое титрование) используется для определения растворенных веществ. Метод основан на взаимодействии определяемого вещества с титрантом, который получают электролизом; титрант в этом случае называют электрогенерированным.
В кулонометрическом титровании могут применяться два способа генерирования титранта: внутренний и внешний. В первом случае титрант получают непосредственно в растворе, который содержит анализируемый компонент. Реже используют второй способ — генерирование титранта в отдельной электролитической ячейке с последующим введением его в раствор анализируемого вещества.
