
1 курс (энергетики) / защита работы 3 / Zaschita_3_bilet_44
.pdfЗадача 2
Электролиз раствора солей CuSO4, NiSO4, FeSO4.
Электроды графитовые, являются инертными
CuSO4→ Cu2+ + SO24
NiSO4→ Ni2+ + SO24
FeSO4→ Fe2+ + SO24 H2O ↔ H+ + OH–
Среда кислая, так как соли образованы сильной кислотой и слабыми основаниями, и подвергаются гидролизу по катиону:
Cu2+ + H2O ↔ CuOH+ + H+
Ni2+ + H2O ↔ NiOH+ + H+
Fe2+ + H2O ↔ FeOH+ + H+
Для расчетов возьмем pH=5
Таким образом, ионный состав раствора: Cu2+ , Ni2+ , Fe2+ , H+, SO24 ; OH– (-) на катоде: Cu2+ , Ni2+ , Fe2+ , H+
(+) на аноде: SO24 ; OH–
На аноде могут окисляться только молекулы H2O (так как среда кислая, то вместо анионов OH–
окисляются молекулы воды). Анионы SO24 никогда не окисляются на аноде при электролизе водных
растворов солей (по причине высокоположительного потенциала E0 2 2 2,01B )
S2O8 / SO4
Значение кислородного потенциала:
EP |
1, 23 0,059 pH 1, 23 0,059 5 0,935B |
O /OH |
|
2 |
|
Анодный процесс: 2H2O – 4ē → O2 + 4H+
На катоде могут восстанавливаться катионы Cu2+ , Ni2+ , Fe2+ , H+
Сравним электродные потенциалы возможных катодных процессов:
EHP / H2 0, 059 pH 0, 059 5 0, 295B
ENi0 2 / Ni 0, 25B
ECu0 2 /Cu 0, 337B
EFe0 2 Fe 0, 44B
В первую очередь восстанавливаются частицы с наибольшим значением потенциала, в данном случае катионы Cu2+, а далее в порядке уменьшения потенциалов восстанавливаются другие частицы:
Cu2+ + 2ē → Cu
Ni2+ + 2ē → Ni
2H+ + 2ē → H2
Fe2+ + 2ē → Fe
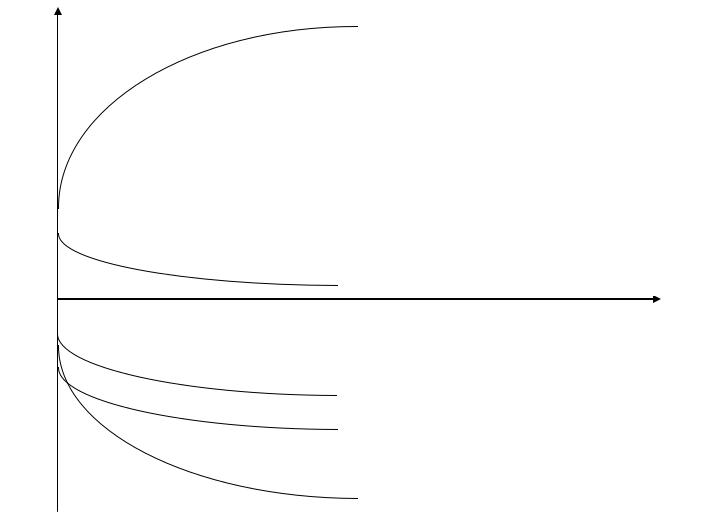
Все процессы восстановления могут протекать, так как разность потенциалов невелика и составляет менее 1В
Предполагаемый ход поляризационных кривых:
Е, В
Поляризационная кривая окисления молекул H2O на аноде
0,935
0,337
Поляризационная кривая восстановления Cu2+ на катоде
i, мА/см2
-0,25
-0,295
-0,44
Поляризационная кривая восстановления Ni2+ на катоде
Поляризационная кривая восстановления Fe2+ на катоде
Поляризационная кривая восстановления H+ на катоде
Теоретическое напряжение разложения равно разности потенциалов первых процессов,
протекающих на аноде и катоде:
U |
РАЗЛ |
E анода – Е катода EP |
E0 2 |
/Cu |
0,935B 0,337B 0,598B |
|
O /OH |
Cu |
|
||
|
|
2 |
|
|
|
Задача 3
Сплав Fe – Pd pH = 3
Возьмем p(O2) = 0,21; p(H2) = 1
Сравним стандартные электродные потенциалы Fe и Pd.
EFe0 2 / Fe 0, 44B
EPd0 2 / Pd 0, 987B
EFe0 2 / Fe EPd0 2 / Pd , при возникновении электрохимической коррозии железо будет анодом (будет окисляться, корродировать), а палладий будет катодом (окисляться не будет).
Возможные окислители при коррозии: молекулы O2 (кислородная деполяризация), катионы H+
(водородная деполяризация).
Определим равновесные потенциалы окислителей:

EP |
1, 23 0, 059 pH 0, 0147 lg p(O ) 1, 23 0, 059 3 0, 0147 lg 0, 21 1, 043B |
||
O2 /OH |
|
|
2 |
|
|
|
|
EP |
0, 059 pH 0, 0295lg p(H |
2 |
) 0, 059 3 0, 0295lg1 0,177B |
H / H2 |
|
|
|
|
|
|
|
Сравним равновесные потенциалы окислителей и стандартный электродный потенциал анода.
E0 |
2 |
|
EP |
|
, коррозия с водородной деполяризацией возможна. |
Fe |
|
/ Fe |
H |
/ H2 |
|
E0 |
2 |
|
EP |
|
, коррозия с кислородной деполяризацией возможна. |
Fe |
|
/ Fe |
O2 /OH |
|
|
Уравнения реакций электродных процессов: |
|||||
А(–): |
Fe – 2ē → Fe2+ |
||||
|
|
+ |
2ē H2 |
(водородная деполяризация в кислой среде) |
||
2H |
|
|||||
K( ) : |
|
4H+ 4ē 2H |
|
|
||
O |
2 |
2 |
O (кислородная деполяризация в кислой среде) |
|||
|
|
|
|
|
||
V (O2 ) 56мл 0, 056л V (H2 ) 28мл 0, 028л
m(Fe) ?
По закону эквивалентов: |
|
|
|
|
|
||||||
|
m(Fe) |
|
V (O2 ) |
|
V (H2 ) |
|
|
|
|||
|
M Э (Fe) |
VЭ (O2 ) |
VЭ (H2 ) |
|
|
|
|
||||
|
|
|
|
|
|
|
V (H2 ) |
|
|
||
m(Fe) |
M Э (Fe) |
|
V (O2 ) |
|
|
|
|||||
|
|
||||||||||
|
|
|
|
VЭ (O2 ) |
|
|
VЭ (H2 ) |
|
|||
|
0, 056л |
|
0, 028л |
|
|
27,9г / моль |
|
|
|
|
0,349г 349мг |
|
|
||||
|
5, 6л / моль |
|
11, 2л / моль |
|
|
Прокорродировало 349 мг железа
