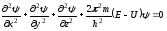Шпоргалка
.docx|
Представление о волновых свойствах электрона позволяет определить смысл «стационарной» орбиты Бора – это орбита, на которой длина волны электрона укладывается целое число раз:
Исходя из представления о волновых свойствах электрона, австрийский физик Эрвин Шредингер в 1925 году предположил, что состояние движущегося в атоме электрона должно описываться известным уравнением стоячей электромагнитной волны:
где - амплитуда волны; - длина волны; x, y, z – координаты. Подставив в это уравнение вместо длины волны ее выражение из уравнения Де Бройля, он получил уравнение, связывающее энергию электрона с пространственными координатами и волновой функцией ψ, соответствующей в этом уравнении амплитуде трехмерного волнового процесса. Волновая функция ψ может принимать как положительные так и отрицательные значения. Однако величина ψ2 всегда положительна. При этом, чем больше ψ2 в данной области пространства, тем выше вероятность пребывания там электрона. Более точно вероятность обнаружения электрона в некотором малом объеме ΔV выражается произведением ψ2 ΔV. Уравнение Шредингера:
|
, где - волновая функция электрона, U – потенциальная энергия, Е – полная энергия, x, y, z – координаты. 2dV- вероятность пребывания электрона в объеме dV. Решение уравнения Шредингера в большинстве случаев представляет сложную математическую задачу. Область пространства вокруг атомного ядра, в которой наиболее вероятно пребывание электрона, называется орбиталью. Квантовомеханическое рассмотрение различных случаев движения микрочастиц в ограниченной области пространства (например, в атоме, молекуле и т.д.) показывает, что волновая функция частицы всегда содержит безразмерные параметры, которые могут принимать ряд целочисленных значений. Эти величины называются квантовыми числами. Они определяют функцию радиального распределения вероятности пребывания электрона в атоме. Состояние электрона в атоме согласно квантово-механическим представлениям можно описать с помощью чисел, называемых квантовыми. Они могут принимать только определенные значения. Эти числа следующие: n – главное квантовое число, l – орбитальное квантовое число, m – магнитное квантовое число, s – спиновое квантовое число. В таблице даны пределы изменений численных и соответствующих им буквенных обозначений, а также характеристики квантовых чисел.
|
||||||||||||||
|
Из соотношения орбитального и магнитного квантовых чисел следует, что l подуровню соответствует (2l +1) способов ориентации, т.е. квантовых ячеек. s- орбиталь может быть ориентирована только одним способом, р- орбиталь – тремя (по координатным осям), а d-орбиталь- пятью и т.д.(рис.) Набор орбиталей с одинаковым значением главного квантового числа n определяет энергетический уровень (иногда применяется термин "электронная оболочка"). Совокупность орбиталей с одинаковыми значениями l образует энергетический подуровень, например, третий энергетический уровень имеет три подуровня: 3s, 3p и 3d. Число энергетических подуровней равно числу значений l. Номер периода в таблице Д.И.Менделеева соответствует максимальному значению n и определяет количество энергетических уровней в атоме. Для обозначения орбитали можно воспользоваться ячеистой моделью, в которой каждой орбитали соответствует клеточка (квантовая ячейка). Число клеточек на подуровне равно числу значений магнитного квантового числа, т.е. числу орбиталей. Таким образом, квантовая ячейка – состояние электрона с одинаковыми значениями главного, орбитального и магнитного квантовых чисел. В
данной модели каждый электрон
обозначается стрелкой, которая может
быть направлена вверх
Емкость подуровней и уровней. Принцип (запрет) Паули: В атоме не может быть двух электронов, имеющих одинаковые значения всех четырех квантовых чисел. Следствие из принципа Паули: в каждую квантовую ячейку (орбиталь) можно поместить только два электрона с противоположными спинами.
|
Правило Гунда. В пределах одного подуровня электроны занимают наибольшее количество квантовых ячеек так, чтобы суммарный спин был максимальным. Предположим, что на 2р-подуровне нужно разместить три электрона. Принцип Паули разрешает три варианта размещения:
Последовательность заполнения орбиталей Электронное строение многоэлектронных атомов обусловлено определенной последовательностью заполнения орбиталей. Эта последовательность, подчиняется принципу наименьшей энергии – любая система, в том числе и электроны в атоме, стремится занять положение с наименьшей энергией. Очевидно, что выгоднее всего электронам разместиться на 1s‑подуровне. Однако принцип Паули ограничивает емкость каждого энергетического подуровня, так как орбиталь может содержать не более двух электронов. Поэтому электроны будут занимать последовательно орбитали в порядке возрастания энергии. Энергия электронов в многоэлектронном атоме определяется двумя квантовыми числами n и l. Распределение энергий уровней и подуровней многоэлектронных атомов в зависимости от n и l подчиняется правилам Клечковского: 1) из двух подуровней меньшей энергией обладают подуровни с наименьшей суммой n+l, поэтому заполнение подуровней происходит в порядке увеличения суммы (n+l) 2) если суммы n+l одинаковы, то наименьшей энергией обладает подуровень с меньшим числом n, т.е. при одинаковых значениях суммы (n+l) заполнение подуровней происходит в порядке возрастания главного квантового числа n.
|
||||||||||||||
|
|
|
||||||||||||||
|
Следствия из правил Клечковского:, - заполнение d–подуровня отстает на один уровень, т.е. 3d заполняется после 4s, 4d – после 5s и т.д., -заполнение f–подуровня отстает на два уровня, т.е. 4f заполняется после 6s, а 5f–после 7s-подуровня. Следует иметь в виду, что энергии подуровней (n-1)d и (n-2)f близки (суммы n+l одинаковы). Наряду с этим, наименьшей энергией обладают состояния с полностью или наполовину заполненными подуровнями, например np3 и np6, (n-1)d5 и (n-1)d10, (n-2)f7 и (n-2)f14. Это является причиной того, что у многоэлектронных атомов может наблюдаться отклонение от рассмотренной закономерности заполнения подуровней. Это отклонение называется проскоком электронов. Проскоки наблюдаются у элементов Сu, Ag, Аu, Сr, Мо, Ru, Pt, La, Ас, Се и других, особенно у элементов 6-го и 7-го периодов, у Pd наблюдается двойной проскок. Примеры электронных конфигураций атомов.
Периодический закон был открыт Д.И.Менделеевым в 1869г., его современная формулировка: свойства элементов находятся в периодической зависимости от их порядкового номера. Теоретическое обоснование периодический закон получил в квантово-механической теории строения атома. Связь между электронным строением атомов и положением элементов в периодической системе
|
Из таблицы следует, что застройка каждого нового энергетического уровня начинается после заполнения внешнего уровня 8-ю электронами. Каждый уровень начинается с заполнения s-подуровня и завершается заполнением р-подуровня. Эти подуровни внешние. Они принадлежат одному энергетическому слою (главное квантовое число одно и то же). Подуровни d- и f – внутренние. По мере последовательного заполнения слоев строение внешних и предвнешних (внутренних) подуровней периодически повторяется. Эта повторяемость наблюдается после заполнения слоев соответственно 8-ю, 18-ю и 32-мя электронами. Через такие же интервалы наблюдается и периодическое изменение свойств химических элементов в периодической системе по мере увеличения порядкового номера. Таким образом, периодическое изменение свойств химических элементов и их соединений есть результат периодического повторения электронных конфигураций атомов.
|
||||||||||||||
|
В каждой клеточке, как правило, указан символ элемента, его порядковый номер и атомная масса. Физический смысл порядкового номера – количество протонов в ядре, и соответственно, количество электронов в электронной оболочке нейтрального атома. Разность между округленным значением атомной массы и порядковым номером соответствует количеству нейтронов в ядре наиболее распространенного изотопа атома элемента. Номер периода совпадает с номером внешнего энергетического уровня и количеством энергетических уровней у атомов. В начале каждого периода расположено по два s-элемента (ns1–2). Завершается период шестью р-элементами (nр1–6). Элементы d-электронного семейства (10 элементов) расположены между s- и р - элементами в 4-, 5-, 6- и 7-м периодах. При этом 3d-элементы находятся в четвертом периоде, 4d – в пятом, 5d – в шестом, 6d – в седьмом периоде. Заполнение d-пoдурoвня отстает на единицу от номера периода (n – 1)d1–10. 14 элементов 4f-электронного семейства (лантаноиды) расположены в 6-м периоде; в 7-м периоде – 14 элементов 5f-электронного семейства (актиноиды). Таким образом, заполнение f-подуровня идет с отставанием на две единицы от номера периода (n – 2)f1–14.. Все элементы d-электронных семейств называются переходными. Элементы f-электронных семейств называются внутренними переходными элементами; элементы, у которых заполняются внешние s- и p-подуровни, называются типическими элементами.
|
Валентные возможности атомов. Повысить валентность атома – значит, увеличить число неспаренных электронов. Каким образом? Разъединение электронной пары и перевод электрона на более высокий энергетический уровень, например, в случае фтора на третий энергетический уровень (n = 3), требует больших энергетических затрат, которые не компенсируются выделением энергии при образовании химических связей. Валентные возможности благородных газов. В основном состоянии атом гелия (1s2) не имеет неспаренных электронов и свободных орбиталей для возбуждения. Валентность гелия в соответствии с положениями спиновой теории равна нулю. Атом неона (...2s22р6 ) также не имеет свободных орбиталей в валентном слое, что объясняет его нулевую валентность. Для элементов третьего и последующих периодов возможно возбуждение электронов на свободные орбитали. Энергия (потенциал) ионизации ( I )– энергия, расходуемая для отрыва валентного электрона от атома. При этом атом превращается в положительно заряженный ион. То наименьшее напряжение поля, при котором атом ионизируется, называется потенциалом ионизации и выражается в электрон-вольтах ( I, эВ). Величина потенциала ионизации характеризует "металличность" свойств элемента. Чем меньше потенциал, чем легче оторвать валентный электрон от атома, тем сильнее у него проявляются свойства металла. Например, у атомов одной и той же подгруппы (IА; IIA; IIIА) с ростом порядкового номера, т.е. сверху вниз, растет радиус атома,
|
||||||||||||||
|
Атомы неметаллов могут не только отдавать, но и присоединять электроны, при этом энергия выделяется, а атом превращается в отрицательно заряженный ион. Эта энергия называется сродством атома к электрону. Сродство к электрону, как и энергия ионизации, как правило, выражается в электрон-вольтах (Е, эВ). Например, сродство к электрону атома водорода равно 0,75 эВ, кислорода 1,47 эВ, фтора 3,45 эВ. Сродство к электрону по подгруппам ослабевает сверху вниз и возрастает по периоду слева направо. Для сравнительной оценки способности атомов притягивать к себе электроны, введено понятие электроотрицательности (ЭО). Электроотрицательность атома зависит от его энергии ионизации и сродства к электрону. Теоретически ЭО определяется как полусумма его энергии ионизации I и сродства к электрону Е: Общие свойства химической связи Энергия связи Е, кДж/моль – энергия, которая выделяется при образовании химической связи, или которую нужно затратить для разрыва связи. Полярность связи. При образовании связи возможны три случая: 1) связь образуется двумя одинаковыми атомами (∆æ=0). В этом случае электронная плотность поровну распределена между связывающимися атомами. Возникает неполярная ковалентная связь; 2) связь образуется двумя атомами со слабо отличающимися электроотрицательностями (∆æ<1,5). Возникает полярная ковалентная связь (диполь); 3) связь образуют два атома с резко различающимися электро-отрицательностями (∆æ>1,5). Возникает ионная связь.
|
Полярность (дипольный момент) молекул определяется не только полярностью связи, но и геометрией молекул. Для многоатомных молекул он равен векторной сумме дипольных моментов отдельных связей. Кратность связи определяется количеством электронных пар, участвующих в образовании связи. Например, в молекуле кислорода осуществляется двукратная связь О=О, а в молекуле азота - трехкратная NN. Чем больше кратность связи, тем она короче, и тем больше ее энергия. Теория ковалентной связи Для объяснения образования ковалентной связи применяют два приближенных метода расчета систем, состоящих из ядер и электронов: - метод валентных связей (ВС), - метод молекулярных орбиталей. Рассмотрим метод валентных связей (локализованных электронных пар). Теория Гейтлера – Лондона. Метод валентных связей (МВС). В 1927 году В.Гейтлер и Ф.Лондон произвели приближенный расчет молекулы водорода. Вначале они рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга и выразили зависимость волновой функции рассматриваемой системы от координат. Далее они предположили, что найденная зависимость сохраняется и при сближении атомов водорода.
|
|
В результате они получили уравнения, позволяющие найти зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. Оказалось, что при совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы, т.е. связь не образуется. При противоположно направленных спинах сближение атомов до некоторого расстояния r0 приводит к снижению энергии системы. При r = r0 система обладает минимальной потенциальной энергией, т. е. находится в самом устойчивом состоянии – образуется связь. Дальнейшее сближение атомов приводит к возрастанию энергии. Таким образом, lcв соответствует длине связи, а выделяющаяся при этом энергия (Есв – энергии связи. Полученные расчетные значения оказались близки к экспериментально найденным величинам. Для молекулы водорода энергия связи составляет 430,9 кДж/моль, а длина связи 0,74Å, что совпадает с экспериментальными данными. Поскольку длина связи меньше суммы радиусов двух атомов водорода (0,53·2=1,06Å). Это позволяет сделать вывод, что при возникновении ковалентной связи происходит перекрывании электронных облаков с образованием молекулярного электронного облака, сопровождающееся уменьшением энергии. Механизм образования связей. Согласно методу ВС химическую связь образуют два электрона с противоположными спинами (связь двухцентровая и двухэлектронная). Например, образование молекулы F2 по методу ВС представляется следующим образом:
|
Возможен и другой механизм образования ковалентной связи за счет неподеленных электронных пар одного атома А (донора) и свободных орбиталей другого В (акцептора):
Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары. Насыщаемость связи - полное использование валентных возможностей атома. Количество связей, которое может образовать атом (его ковалентность), определяется количеством неспаренных электронов в основном и возбужденном состояниях атома. Ковалентность может быть повышена также за счет образования дополнительных донорно-акцепторных связей. Направленность связи. Поскольку перекрывающиеся облака определенным образом направлены в пространстве, возникающая химическая связь имеет направленный характер. Различают -, - и - связи. - связи получаются в результате взаимного перекрывания орбиталей вдоль линии, соединяющей центры атомов. -связи возникают при перекрывании орбиталей в направлении, перпендикулярном линии связи. -связи возникают при перекрывании всех четырех лепестков d-орбиталей в параллельных плоскостях Итак, согласно методу ВС ковалентная химическая связь – двуцентровая, двухэлектронная, локализованная, направленная и насыщенная.
|
|
Геометрия и свойства молекул, образующихся из нормального состояния атомов
Молекулы типа А2: H2, O2, N2 линейные, неполярные. Кратность связи равна 1,2,3 соответственно. Они образуются двумя одинаковыми атомами, между которыми могут возникать: - одна одинарная σ- связь, за счет перекрывания двух s-(молекулы Н2) или двух р- орбталей (молекулы Cl2), - двукратная связь – одна σ- и одна π- связи (молекулы О2), - трехкратная - одна σ- и две π- связи (молекулы N2). Молекулы типа АВ: HF, HCl, HBr, HI линейные, полярные. Молекулы типа А2В: H2O, H2S, H2Se, H2Te, H2Po угловые (α ≥ 90˚), полярные. Молекулы типа АВ3: NH3, PH3, AsH3, SbH3 имеют форму тригональной пирамиды, (α ≥ 90˚), полярные. Основные положения теории гибридизации: (Л.Полинг и Дж.Слейтер, 1931г.). 1. При гибридизации, т.е. смешивании валентных орбиталей различных подуровней, возникают новые (гибридные) орбитали, промежуточные по форме и энергии. 2. Число образующихся гибридных орбиталей всегда равно числу смешивающихся орбиталей. 3. Связи, возникающие путем перекрывания гибридных орбиталей, совершенно одинаковы (имеют одну и ту же энергию и длину) и направлены симметрично. Исходя из этого, образующиеся при этом молекулы неполярны или малополярны. 4. Гибридные электронные облака асимметричны (рис.), поэтому они могут образовывать только σ-связи; перекрывание орбиталей происходит в большей степени и химические связи обладают большей прочностью, чем связи, образованные за счет негибридных электронных орбиталей. 5. При образовании кратных связей, π- связи образуются за счет негибридных орбиталей. 6. Геометрическую форму молекулы определяют σ-связи. 7. Тип гибридизации определяется типом и количеством смешивающихся орбиталей (sp-, sp2-, sp3-, dsp2-, dsp3-, sp3d2- ).
|
Для объяснения такого несоответствия Л.Полинг и Дж.Слейтер разработали теорию гибридизации. Сущность ее состоит в том, что близкие по энергии валентные орбитали с различной симметрией преобразуются в такое же количество одинаковых гибридных орбиталей, каждая из которых представляет собой продукт смешения исходных орбиталей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание. sp-Гибридизация характерна для элементов II группы, но возможна и для атомов других элементов, образующих две s-связи с участием одной s- и одной р-орбиталей. Участие в образовании связей одной s- и двух р-орбиталей центрального атома приводит к sp2-гибридизации. Гибридизация такого типа характерна для соединений элементов III группы. sp3-Гибридизация, в которой участвуют s-орбиталь и все три p-орбитали, характерна для соединений элементов IV группы периодической системы, в частности для насыщенных углеводородов. В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. При образовании комплексного иона [АlF6]3– происходит sp3d2-гибридизация, в которой участвуют вакантные d-орбитали: Наличие π-связей также не влияет на тип гибридизации. Однако наличие дополнительного связывания может привести к изменению валентных углов, поскольку электроны кратных связей сильнее отталкиваются друг от друга. Гибридизация в молекулах с кратными связями (частичная гибридизация). При образовании кратных связей наряду с σ- образуются π-связи. В связи с этим можно предположить частичную гибридизацию, при которой часть электронов не участвует в гибридизации, оставаясь на р-орбиталях, и именно они являются ответственными за образование π-связей. Так, молекулах ацетилена С2Н2 и диоксида углерода СО2 каждый атом углерода образует две π- и две σ- связи, что позволяет предположить sp –гибридизацию. В молекулах этилена С2Н4 и бензола С6Н6 каждый атом углерода образует одну π- и три σ- связи. Учитывая вышесказанное, можно предположить, что в этих случаях имеет место sp2 –гибридизация. Такие предположения подтверждены экспериментально – валентные углы в этих молекулах соответственно 180 и 1200 .
|
|
Ионная связь. Свойства ионной связи. Электроны в ионных соединениях в высшей степени локализованы, т.е. принадлежат одному из атомов. В отличие от ковалентной связи ионная связь ненаправлена, так как силовое поле ионов равномерно распределяется во всех направлениях. Ионная связь теоретически ненасыщаема, так как энергетически выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Следует заметить, однако, что вследствие волновой природы электрона полное разделение зарядов невозможно. В растворах ионных соединений нет молекул. При растворении в полярных растворителях (вода, спирты и т.п.) ионные соединения полностью диссоциируют, а в неполярных (ССl4, С6Н6 и т.п.) – они обычно нерастворимы. Соединения с ионными кристаллическими решетками имеют высокие температуры плавления и кипения. Многие ионные кристаллы относятся к классу диэлектриков. При стандартных условиях их электропроводность на десятки порядков ниже, чем у металлов. С ростом температуры наблюдается увеличение электропроводности. Металлическая связь. Некоторые свойства металлов, такие, например, как высокая тепло- и электропроводность, ковкость, способность образовывать кристаллические решетки с высокими координационными числами (8, 12) дают основание заключить, что электроны в металле не связаны с какими-либо конкретными атомами, а перемещаются по всей конденсированной фазе достаточно свободно, что обусловливает их высокие тепло- и электропроводность. Наличие делокализованных электронов связано с ненаправленным характером химических связей, поэтому атомы металлов легко перемещаются из одного равновесного положения в другое, что обусловливает ковкость этих веществ. В металлах, очевидно, небольшое число электронов одновременно связывает большое число ядер. Таким образом, химическая связь в металлах не локализована и не направлена. Металл можно рассматривать как плотно упакованную структуру из катионов, связанных друг с другом «электронным газом». ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Реакции, протекающие с изменением степени окисления элементов, относятся к окислительно-восстановительным (О В Р ) реакциям. BaCl2 + Na2SO4 = BaSO4↓ + 2 NaCl - реакция обмена Sn+2Cl2 + Fe+3Cl3 → Fe+2Cl2 + Sn+4Cl4 - ОВР Перепишем уравнение ОВР в ионном виде и подчеркнем ион-окислитель и восстановитель: Sn2+ +2Cl‾ + Fe3+ + 3Cl‾ → Fe2+ + 2Cl‾ + Sn4+ + 4Cl‾ (1) 1│Sn2+ – 2ē = Sn4+ - процесс окисления Sn2+восстановитель 2│Fe3+ + ē = Fe2+ - процесс восстановления Fe3+ - окислитель |
Окислитель – принимает электроны и при этом восстанавливается (процесс восстановления – процесс присоединения электронов), восстановитель – отдает электроны и при этом окисляется (процесс окисления – процесс отдачи электронов). В результате реакции окисления степень окисления восстановителя повышается, а степень окисления окислителя при восстановлении понижается. В процессе окисления и восстановления должно участвовать одинаковое количество электронов. Поэтому нужно умножить первую строчку на один, а вторую - на два и сложить: Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+ Это окончательное уравнение реакции в ионном виде. Степень окисления и валентность. Восстановители. Мерой восстановительной способности является величина ионизационного потенциала. Восстановителями могут быть: а) металлы: Ме - nē = Меn+, например Cu - ē = Cu+; Pb - 2ē = Pb2+. б) отрицательно заряженные ионы неметаллов: 2I‾ - 2ē = I2 S2‾, Se2‾, Te2‾, I‾, Br‾, Cl‾ 4) сложные ионы или молекулы, содержащие атомы в промежуточной степени окисления. Например, Fe2+ - ē = Fe3+ Pb2+ -2ē = Pb4+ Sn2+ - 2ē =Sn4+ SO32‾, CrO2‾, AsO33‾, NO2‾ - ионы, SO2, NO, MnO2 - молекулы. Окислители. Мерой окислительной способности являются величины сродства к электрону и электроотрицательности. Окислителями могут быть: 1) нейтральные атомы неметаллов(на внешнем уровне 4,5,6,7ē ): Cl2 + 2ē =2Cl‾, S + 2ē = S2‾. Самым сильным окислителем является фтор F2 2) Ионы и молекулы, содержащие атомы металлов и неметаллов в высшей и промежуточной степенях окисления: Pb4+, Sn4+, Cr3+, Fe3+, (ионы благородных металлов Ag+, Au+ ) CrO42‾, Cr2O72‾, MnO4‾, NO3‾, SO42‾, SeO42‾, ClO4‾. Факторы, влияющие на протекание ОВР: - природа взаимодействующих веществ; - температура; - катализаторы; - концентрация: - рН среды. Классификация ОВР. 1) Реакции межмолекулярного окисления-восстановления (окислитель и восстановитель - в разных молекулах): - реакции вытеснения Zn + CuSO4 = ZnSO4 + Cu - реакции синтеза H2 + Br2 = 2HBr - реакции с участием среды (примеры с KMnO4, K2Сr2O7). Пример межмолекулярной ОВР. Взаимодействие K2Cr2O7 c KI в кислой среде. 2) Реакции диспропорционирования (самоокисления - самовосстановления): 3) Реакции внутримолекулярного окисления-восстановления (окислитель и восстановитель находятся в одной молекуле): |