
- •Лабораторна робота № 5
- •Хімічна кінетика
- •Вплив каталізатора
- •Лабораторна робота № 6 розчини. Закони ідеальних розчинів.
- •Способи вираження концентрацiй розчинiв
- •Лабораторна робота № 7 розчини електролітів
- •Константа дисоціації при 2025 с
- •Лабораторна робота № 8 гідроліз солей
- •Добуток розчинності
- •Методичні вказівки для підготовки до лабораторних робіт з курсу хімії
Лабораторна робота № 5
ХІМІЧНА КІНЕТИКА. ХІМІЧНА РІВНОВАГА.
Хімічна кінетика
Розділ хімії, який розглядає швидкості і механізми хімічних процесів, називається хімічною кінетикою. Швидкість хімічної реакції число елементарних актів взаємодії за одиницю часу. Для гомогенних реакцій швидкість визначається як зміна концентрацій вихідних речовин або продуктів реакції за одиницю часу.
![]() Середня
швидкість реакції в проміжках часу
= 2
– 1
Середня
швидкість реакції в проміжках часу
= 2
– 1
де c = c2 c1 – зміна концентрації.
![]() Для продуктів
реакції перед відношенням ставиться
знак плюс
, для вихідних речовин – знак мінус.
Істинна швидкість реакції в момент часу
Швидкість реакції залежить від природи
реагуючих речовин, їх концентрації,
температури, наявності каталізатора.
Для продуктів
реакції перед відношенням ставиться
знак плюс
, для вихідних речовин – знак мінус.
Істинна швидкість реакції в момент часу
Швидкість реакції залежить від природи
реагуючих речовин, їх концентрації,
температури, наявності каталізатора.
Вплив концентрації. Порядок і молекулярність реакції.
Залежність швидкості реакції від концентрації реагуючих речовин описується кінетичним рівнянням, яке визначається експериментально.
Для реакції aA + bB = Cc + dD; v = kCАnA CBnB , де СА і СВ концентрації компонентів А і В; nA і nB – порядки реакції по компонентах А і В.
Порядком реакції по даному компоненту називається показник ступеня при концентрації цього компонента в кінетичному рівнянні- Загальний порядок реакції n дорівнює сумі порядків реакції по окремих компонентах: n = nA + nB; k – константа швидкості реакції, яка чисельно дорівнює швидкості реакції при концентрації реагуючих речовин чи їх добутку, що дорівнює 1; значення k не залежить від концентрацій реагуючих речовин і є сталим при сталій температурі.
Кінетичне рівняння залежить від механізму реакції, тобто від того, через які стадії відбувається даний процес. Якщо реакція відбувається в одну стадію, вона називається простою. Найчастіше реакції є складними, тобто перетворення вихідних речовин у кінцеві проходить через ряд елементарних стадій. Для простих реакцій чи елементарних стадій справедливий закон діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин у ступенях, що дорівнюють їх стехіометричним коефіцієнтам.
Наприклад, для реакції Н2 + І2 2НІ, яка є простою реакцією першого порядку по Н2 і І2, сумарний порядок дорівнює 2, кінетичне рівняння має вигляд v = k[H2][I2].
Для складних реакцій кінетичне рівняння не відповідає стехіометричному. Так, для реакції 2N2O5 = 4NO2 + O2 кінетичне рівняння таке: v = k[N2O5]. Реакція відбувається через стадії:
N2O5 = N2O3 + O2; (1)
N2O5 + N2O3 = 4NO2. (2)
Перша стадія, більш повільна, лімітує швидкість усієї реакції і визначає її перший порядок по N2O5.
Число молекул, які беруть участь в елементарному акті хімічного перетворення, називається молекулярністю. Так, перша стадія – мономолекулярна, друга бімолекулярна. Для простих реакцій порядок і молекулярність співпадають, для складних не співпадають.
Приклад 1. Визначити вид кінетичного рівняння для реакцій в газовій фазі:
A + B + 2D = F + L, якщо при збільшенні концентрації СА в 2, 3, 4 раза швидкість реакції v збільшилась в 2, 3, 4 раза, при такому ж збільшенні CB не змінилась, а CD – збільшилось в 4, 9, 16 раз. Як зміниться швидкість реакції при збільшенні тиску в 2 рази?
Розв’язок:
З умови задачі виходить, що v залежить прямопропорційно від CA, не залежить від CB і пропорційна квадрату CD, тобто v = kCA1CB0CD2. Отже, реакція першого порядку по A, нульового по B, другого по D. Загальний порядок реакції дорівнює 1+ 0 + 2 = 3.
 При підвищенні
тиску в 2 рази концентрація кожної
речовини в газовій фазі зростає в 2
рази. Тоді
При підвищенні
тиску в 2 рази концентрація кожної
речовини в газовій фазі зростає в 2
рази. Тоді
Відповідь: кінетичне рівняння має вигляд v = k CA1CB0CD2; швидкість реакції збільшується в 8 разів.
Вплив температури
![]() В
більшості випадків швидкість реакції
збільшується при підвищенні температури.
Згідно з правилом Вант-Гоффа, при
збільшенні температури на 10 оС
швидкість реакції збільшується в 2 – 4
рази, тобто
В
більшості випадків швидкість реакції
збільшується при підвищенні температури.
Згідно з правилом Вант-Гоффа, при
збільшенні температури на 10 оС
швидкість реакції збільшується в 2 – 4
рази, тобто
П![]()
 равило
Вант-Гоффа можна
також
виразити так:
равило
Вант-Гоффа можна
також
виразити так:
де γ температурний коефіцієнт швидкості реакції, який показує, в скільки разів підвищується швидкість реакції при збільшенні температури на 10.
Приклад 2. Визначити, в скільки разів збільшиться швидкість реакції при збільшенні температури на 40 оС, якщо температурний коефіцієнт швидкості цієї реакції дорівнює 3.
Розв’язок.
 Згідно з правилом
Вант-Гоффа розраховуємо відношення
швидкостей при збільшенні температури:
Згідно з правилом
Вант-Гоффа розраховуємо відношення
швидкостей при збільшенні температури:
Відповідь: швидкість реакції збільшиться в 81 раз.
![]() Залежність
константи швидкості від температури
встановлюється рівнянням Арреніуса:
Залежність
константи швидкості від температури
встановлюється рівнянням Арреніуса:
д![]() еАпередекспоненціальний
множник, який характеризує загальне
число співударів молекул, сприятливих
в просторовому відношенні;
еАпередекспоненціальний
множник, який характеризує загальне
число співударів молекул, сприятливих
в просторовому відношенні;
Еа
– енергія
активації, Дж/моль – різниця між енергією,
необхідною для взаємодії і середньою
енергією молекул; Т
–
абсолютна
температура; R
– універсальна газова стала;
![]() --
доля
активних зіткнень.
--
доля
активних зіткнень.
Збільшення швидкості реакції з підвищенням температури, пов’язане зі зростанням числа активних молекул.
Приклад 3. Розрахувати енергію активації реакції, якщо при температурі Т1 = 273 К константа рівноваги k дорівнює 4,04.10-5 c-1, а при T2 = 280 K k = 7,72.10-5 c-1.
Розв’язок:
![]() Використовуємо
рівняння Арреніуса.
Використовуємо
рівняння Арреніуса.
R = 8,3 Дж/(моль . К); lnA = 2,3. lgA;
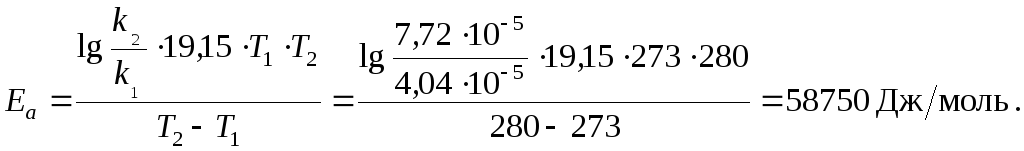
Відповідь: енергія активації дорівнює 58750 Джмоль.
