
ТОТ (лекции) / ТД(лекц_я 4)
.doc
Л е к ц і я 1.4. Аналіз термодинамічних процесів з ідеальним газом.
Задачі аналізу термодинамічних процесів ідеального газу і загальні аналітичні залежності. Ізохорний процес. Ізобарний процес. Ізотермічний процес. Адіабатний процес. Політропний процес та його узагальнююче значення. Якісний аналіз процесів за допомогою p-v і T-s діаграм.
Джерела інформації: [1], с.80-96; [2], с.44-56; [8], с.98-118;
Задачі аналізу та порядок
його виконання. Задачею
аналізу будь-якого
термодинамічного процесу є установлення
закономірностей зміни параметрів стану
робочого тіла та виявлення особливостей
перетворення енергії. Порядок
виконання аналізу
наступний: виводиться рівняння процесу
у
![]() і
і
![]() координатах; установлюється залежність
між основними параметрами робочого
тіла на початку і в кінці процесу;
визначаються зміни питомої внутрішньої
енергії, питомої ентальпії та питомої
ентропії процесу (процеси вважаються
оборотними); розраховуються питомі
робота і теплота процесу. До основних
процесів, які мають велике значення як
у практичному, так і теоретичному
відношеннях, належать:
ізохорний – при
постійному об'ємі; ізобарний
– при постійному
тиску; ізотермічний
– при постійній температурі; адіабатний
– без зовнішнього
теплообміну.
координатах; установлюється залежність
між основними параметрами робочого
тіла на початку і в кінці процесу;
визначаються зміни питомої внутрішньої
енергії, питомої ентальпії та питомої
ентропії процесу (процеси вважаються
оборотними); розраховуються питомі
робота і теплота процесу. До основних
процесів, які мають велике значення як
у практичному, так і теоретичному
відношеннях, належать:
ізохорний – при
постійному об'ємі; ізобарний
– при постійному
тиску; ізотермічний
– при постійній температурі; адіабатний
– без зовнішнього
теплообміну.
Ізохорний процес. Процес при постійному об'ємі зветься ізохорним (v=const і dv=0). У p – v координатах графік процесу (ізохора) – пряма лінія, яка паралельна осі ординат (рис. 4.1, а). З рівняння стану ідеального газу маємо рівняння ізохорного процесу:
![]() . (4.1)
. (4.1)
Таким чином при v=const
тиск газу змінюється прямо пропорційно
його абсолютній температурі:
![]() ,
а термодинамічна робота газу дорівнює
нулю
,
а термодинамічна робота газу дорівнює
нулю
![]() .
.
Питома корисна (наявна) робота, яка може бути передана зовнішньому об'єкту, дорівнює:
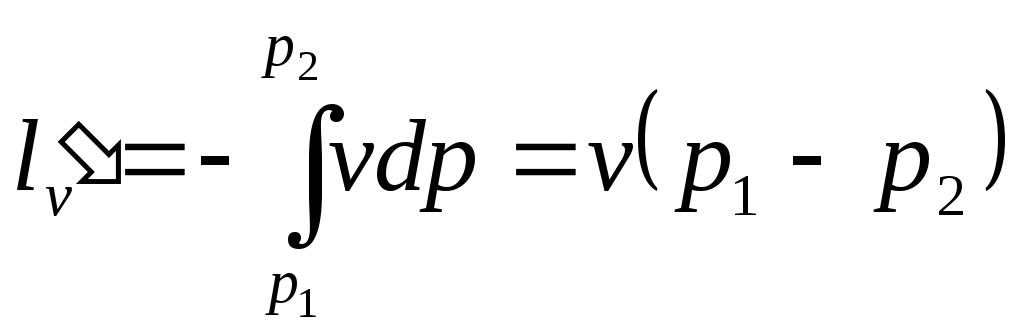 . (4.2)
. (4.2)
Рівняння першого закону
термодинаміки для ізохорного процесу
прийме вид
![]() ,
а питома теплота процесу при
постійній теплоємності дорівнює:
,
а питома теплота процесу при
постійній теплоємності дорівнює:
 . (4.3)
. (4.3)
Вся зовнішня теплота у ізохорному процесі витрачається тільки на зміну внутрішньої енергії тіла. При змінній теплоємності у процесі
![]() , (4.4)
, (4.4)
де
![]() – середня питома ізохорна
теплоємність у інтервалі температур
– середня питома ізохорна
теплоємність у інтервалі температур
![]() .
.
Якщо процес здійснюється зі збільшенням тиску, теплота підводиться, при цьому збільшуються внутрішня енергія і температура газу. Навпаки, якщо тиск у процесі знижується, теплота відводиться , а внутрішня енергія і температура газу зменшуються.
Зміна питомої ентальпії (![]() ):
):
![]() , (4.5)
, (4.5)
де
![]() – середня питома ізобарна
теплоємність у інтервалі температур
– середня питома ізобарна
теплоємність у інтервалі температур
![]() .
.
Зміну питомої ентропії у оборотному процесі можна знайти з рівняння
![]() . (4.6)
. (4.6)
Для ізохорного процесу
![]() і
і
![]() ,
тому
,
тому
 . (4.7)
. (4.7)
З цього рівняння виходить,
що залежність ентропії від температури
у ізохорному процесі має логарифмічний
характер (рис. 4.2, б).
Піддотична до ізохори 1-2
на рис. 4.2 у будь-якій точці дає значення
істинної теплоємності
![]() .
Ізохори різних об'ємів є еквідистантними
кривими (процеси 1-2
і 1а-2а),
які мають при однакових температурах
однакові кутові коефіцієнти і обернені
випуклістю донизу. Чим більше об'єм
газу, тим далі знаходиться ізохора від
осі ординат.
.
Ізохори різних об'ємів є еквідистантними
кривими (процеси 1-2
і 1а-2а),
які мають при однакових температурах
однакові кутові коефіцієнти і обернені
випуклістю донизу. Чим більше об'єм
газу, тим далі знаходиться ізохора від
осі ординат.

а б
Рис. 4.1. Графіки ізохорного процесу у p-v координатах (а) і T-s координатах (б)
 Схема
енергетичного балансу для ізохорного
процесу показана на рис. 4.2. Частка
питомої теплоти, яка витрачається на
зміну внутрішньої енергії ідеального
газу у ізохорному процесі
Схема
енергетичного балансу для ізохорного
процесу показана на рис. 4.2. Частка
питомої теплоти, яка витрачається на
зміну внутрішньої енергії ідеального
газу у ізохорному процесі
![]() . Рис.4.3
. Рис.4.3
Рис. 4.2
Ізобарний процес. Процес при постійному тиску зветься ізобарним (p=const і dp=0). У p-v координатах графік процесу (ізобара) – горизонтальна пряма (рис. 4.3, а). З рівняння стану ідеального газу маємо рівняння ізобарного процесу:
![]() .
(4.8)
.
(4.8)
Таким чином при p
= const об'єм
газу змінюється прямо пропорційно його
абсолютній температурі:
![]() ,
а наявна робота газу (
,
а наявна робота газу (![]() )
дорівнює нулю. При розширенні газу його
температура зростає, а при стисненні –
зменшується.
)
дорівнює нулю. При розширенні газу його
температура зростає, а при стисненні –
зменшується.
Питома термодинамічна робота процесу
 . (4.9)
. (4.9)
Рівняння першого закону
термодинаміки для ізобарного процесу
прийме вид
![]() ,
а питома теплота процесу при
постійній теплоємності дорівнює:
,
а питома теплота процесу при
постійній теплоємності дорівнює:
 . (4.10)
. (4.10)
Вся зовнішня теплота у ізобарному процесі витрачається на зміну ентальпії тіла. При змінній теплоємності у процесі
![]() , (4.11)
, (4.11)
де
![]() –
середня питома ізобарна
теплоємність у інтервалі температур
–
середня питома ізобарна
теплоємність у інтервалі температур
![]() .
.
Зміна питомої внутрішньої
енергії (![]() ):
):
![]() ,
,
де
![]() – середня питома ізохорна
теплоємність у інтервалі температур
– середня питома ізохорна
теплоємність у інтервалі температур
![]() .
.
Для оборотного процесу зміна питомої ентропії
![]() , (4.12)
, (4.12)
але
при
![]()
![]() ,
тому
,
тому
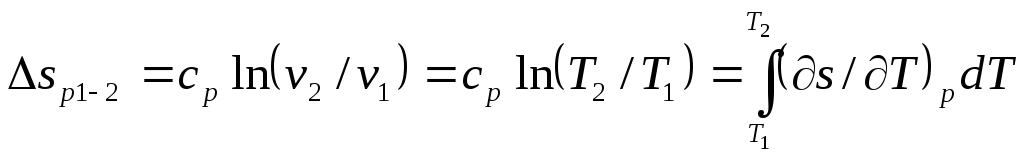 . (4.13)
. (4.13)
Ізобара на T
– s
діаграмі зображається
логарифмічною кривою, яка обернена
випуклістю донизу (рис. 4.3, б).
Піддотична до кривої 1-2
у будь-якій її точці дає значення істинної
теплоємності ср.
Усі ізобари є еквідистантними кривими,
які мають при однакових температурах
однакові кутові коефіцієнти. Чим більше
тиск, тим ближче ізобара до осі ординат
![]() .
Ізобара йде більш полого, ніж ізохора
.
Ізобара йде більш полого, ніж ізохора
![]() .
.


а б
Рис. 4.3. Графіки ізобарного процесу у p-v координатах (а) і T-s координатах (б)
 Схема енергетичного балансу
для ізобарного процесу показана на рис.
4.4. Частина теплоти
Схема енергетичного балансу
для ізобарного процесу показана на рис.
4.4. Частина теплоти
![]() ,
переходить у роботу розширення, а інша
частина йде на збільшення внутрішньої
енергії.
,
переходить у роботу розширення, а інша
частина йде на збільшення внутрішньої
енергії.
Частка теплоти, яка витрачається на зміну внутрішньої енергії ідеального газу у ізобарному процесі:
![]()
Рис. 4.4
Ізотермічний процес. Процес, який протікає при постійній температурі (T = const і dT = 0), називається ізотермічним, а графік процесу – ізотермою. Рівняння процесу витікає з рівняння стану ідеального газу
![]() (4.14)
(4.14)
або
![]() і
і
![]() . (4.15)
. (4.15)
При постійній температурі об'єм газу змінюється обернено пропорційно його тиску. Термодинамічна робота процесу (робота зміни об'єму):

. (4.16)
У зв'язку з тим, що температура
ізотермічного процесу T
= const,
внутрішня енергія і ентальпія ідеального
газу також не змінюються (![]() ,
,
![]() ).
Отже, відповідно до першого закону
термодинаміки уся підведена до газу
теплота повністю перетворюється у
роботу розширення і розраховується за
формулою (4.16) або
).
Отже, відповідно до першого закону
термодинаміки уся підведена до газу
теплота повністю перетворюється у
роботу розширення і розраховується за
формулою (4.16) або
 . (4.17)
. (4.17)
Таким чином у ізотермічному
процесі ідеального газу робота зміни
об'єму, наявна робота і теплота, отримана
тілом, рівні між собою:
![]() .
При ізотермічному стисненні від газу
відводиться теплота у кількості, яка
дорівнює витраченій на стиснення роботі.
Теплоємність ізотермічного процесу
.
При ізотермічному стисненні від газу
відводиться теплота у кількості, яка
дорівнює витраченій на стиснення роботі.
Теплоємність ізотермічного процесу
![]() .
Зміна ентропії у ізотермічному процесі:
.
Зміна ентропії у ізотермічному процесі:
![]() . (4.18)
. (4.18)
Графіком ізотермічного процесу у p – v координатах є рівнобічна гіпербола (рис. 4.5, а), а у T – s координатах – пряма, яка паралельна вісі абсцис (рис. 4.5, б).


а б
Рис. 4.5. Графіки ізотермічного процесу у p-v координатах (а) і T-s координатах (б)
 Частка
теплоти, яка витрачається на зміну
внутрішньої енергії ідеального газу у
ізотермічному процесі,
Частка
теплоти, яка витрачається на зміну
внутрішньої енергії ідеального газу у
ізотермічному процесі,
![]() .
.
Схема енергетичного балансу для ізотермічного процесу показана на рис. 4.6.
Рис. 4.6
Адіабатний процес.
Процес, при якому робоче тіла не
обмінюється теплотою з навколишнім
середовищем (![]() ),
називається адіабатним,
а графік процесу – адіабатою.
Щоб здійснити такий процес, необхідно
або теплоізолювати газ, тобто розмістити
його у адіабатній оболонці, або здійснити
процес настільки швидко, щоб зміна
температури газу, зумовлена його
теплообміном з навколишнім середовищем,
була знехтувано малою у порівнянні зі
зміною температури, викликаною розширенням
або стисненням газу. Як правило, це
можливо, бо теплообмін відбувається
значно повільніше, чим стиснення або
розширення газу. Оборотний адіабатний
процес можна здійснити у циліндрі з
абсолютно нетеплопровідними стінками
при нескінченно повільному переміщенні
поршня.
),
називається адіабатним,
а графік процесу – адіабатою.
Щоб здійснити такий процес, необхідно
або теплоізолювати газ, тобто розмістити
його у адіабатній оболонці, або здійснити
процес настільки швидко, щоб зміна
температури газу, зумовлена його
теплообміном з навколишнім середовищем,
була знехтувано малою у порівнянні зі
зміною температури, викликаною розширенням
або стисненням газу. Як правило, це
можливо, бо теплообмін відбувається
значно повільніше, чим стиснення або
розширення газу. Оборотний адіабатний
процес можна здійснити у циліндрі з
абсолютно нетеплопровідними стінками
при нескінченно повільному переміщенні
поршня.
Для отримання рівняння
адіабати, запишемо перший закон
термодинамікм у двох формах з урахуванням
того, що
![]() ,
,
![]() ,
а
,
а
![]() :
:
![]() ,
,
![]() .
.
Якщо поділити перше рівняння
на друге і підставити
![]() ,
отримаємо
,
отримаємо
![]() . (4.19)
. (4.19)
Інтегруючи останнє рівняння
при умові, що показник адіабати
![]() ,
,

знаходимо
![]() .
.
Після потенціювання отримаємо рівняння адіабати
![]() , (4.20)
, (4.20)
або
![]() . (4.21)
. (4.21)
При адіабатному процесі добуток тиску на об'єм газу у степені k є величина постійна. З рівняння адіабати витікає, що
![]() і
і
![]() . (4.22)
. (4.22)
Якщо ці співвідношення
підставити у рівняння
![]() для крайніх точок процесу, після
перетворень знайдемо:
для крайніх точок процесу, після
перетворень знайдемо:
 . (4.23)
. (4.23)
Термодинамічна робота при
адіабатному процесі згідно з першим
законом термодинаміки здійснюється за
рахунок зменшення внутрішньої енергії
ідеального газу
![]() і може бути обчислена при
і може бути обчислена при
![]() за формулою:
за формулою:
![]() ,
,
а
з урахуванням того, що
![]() (
(![]() і
і
![]() ),
),
![]()
або
![]() . (4.24)
. (4.24)
З
урахуванням
 з останнього рівняння (4.24) отримаємо:
з останнього рівняння (4.24) отримаємо:
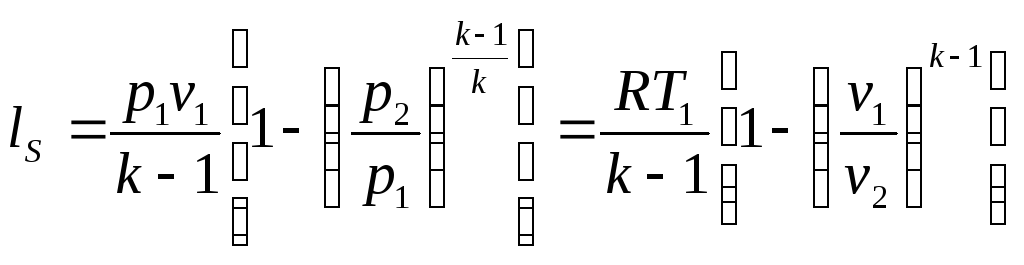
. (4.25)
При адіабатному процесі
наявна робота у k
разів більше термодинамічної
роботи
![]() ,
що виходить з рівняння (4.19), отже
,
що виходить з рівняння (4.19), отже
![]() . (4.26)
. (4.26)
Для оборотного адіабатного
процесу
![]() ,
тому
,
тому
![]() і
і
![]() ,
отже адіабатний процес є одночасно
ізоентропійним
,
отже адіабатний процес є одночасно
ізоентропійним
![]() .
Теплоємність адіабатного процесу
дорівнює нулю:
.
Теплоємність адіабатного процесу
дорівнює нулю:
![]() =
0. У
=
0. У
![]() координатах адіабата зображається
нерівнобічною гіперболою (рис. 4.7, а),
яка йде крутіше за ізотерму, оскільки
координатах адіабата зображається
нерівнобічною гіперболою (рис. 4.7, а),
яка йде крутіше за ізотерму, оскільки
![]() :
при адіабатному розширенні тиск
знижується швидше, ніж при ізотермному,
тому що у процесі розширення зменшується
температура газу. У
:
при адіабатному розширенні тиск
знижується швидше, ніж при ізотермному,
тому що у процесі розширення зменшується
температура газу. У
![]() координатах адіабата зображується
вертикальною прямою (рис. 4.7, б).
Необоротний адіабатний процес не є
ізоентропійним і незалежно від його
спрямованості як при розширенні , так
і при стисненні супроводжується
зростанням ентропії.
координатах адіабата зображується
вертикальною прямою (рис. 4.7, б).
Необоротний адіабатний процес не є
ізоентропійним і незалежно від його
спрямованості як при розширенні , так
і при стисненні супроводжується
зростанням ентропії.


а б
Рис. 4.7. Графіки адіабатного процесу у p-v координатах (а) і T-s координатах (б)
 Схема енергетичного балансу адіабатного
процесу показана на рис. 4.8.
Схема енергетичного балансу адіабатного
процесу показана на рис. 4.8.
Доля теплоти, яка витрачається на зміну внутрішньої енергії ідеального газу у цьому процесі, не має смислу.
Рис. 4.8
Політропний процес і його
узагальнююче значення. Кожний
процес зміни стану робочого тіла, який
відбувається при постійній теплоємності,
зветься політропним,
а графік процесу – політропою.
Рівняння цього процесу можна отримати
на основі першого закону термодинаміки,
який, з урахуванням того що
![]() ,
,
![]() і
і
![]() ,
можна записати
,
можна записати
![]() ,
,
![]() .
.
Поділивши друге рівняння на перше, отримаємо
![]() .
.
Позначивши ліву частину
останнього рівняння
![]() ,
отримаємо
,
отримаємо
![]() . (4.27)
. (4.27)
Після інтегрування рівняння (4.27) отримаємо рівняння політронного процесу:
![]() (4.28)
(4.28)
або
![]() . (4.29)
. (4.29)
Величина
![]() ,
яка залежить від теплоємност
,
яка залежить від теплоємност
![]() політропного процесу, зветься показником
політропи. Показник політропи
сталий для конкретного процесу. Значення
його змінюється від
політропного процесу, зветься показником
політропи. Показник політропи
сталий для конкретного процесу. Значення
його змінюється від
![]() до
до
![]() в залежності від теплоємності
в залежності від теплоємності
![]() і визначає характер процесу.
Політропний процес є узагальнюючим.
Усі розглянуті вище процеси – його
окремі випадки. Рівняння чотирьох
основних термодинамічних процесів
витікають з рівняння політропного
процесу
і визначає характер процесу.
Політропний процес є узагальнюючим.
Усі розглянуті вище процеси – його
окремі випадки. Рівняння чотирьох
основних термодинамічних процесів
витікають з рівняння політропного
процесу
![]() при таких значеннях показника політропи:
при таких значеннях показника політропи:
![]()
![]() – ізобарний процес;
– ізобарний процес;
![]()
![]() – ізохорний прпоцес;
– ізохорний прпоцес;
![]()
![]() – ізотермічний процес;
– ізотермічний процес;
![]()
![]() – адіабатний процес.
– адіабатний процес.
Оскільки рівняння політропи
відрізняється від рівняння адіабати
тільки значенням показника
![]() ,
усі співвідношення між основними
параметрами
,
усі співвідношення між основними
параметрами
![]() для політропного процесу можуть бути
представлені формулами адіабатного
процесу, якщо показник адіабати
для політропного процесу можуть бути
представлені формулами адіабатного
процесу, якщо показник адіабати
![]() замінити на показник політропи
замінити на показник політропи
![]() :
:
![]() ;
;
![]() ;
;
![]() . (4.30)
. (4.30)
Рівняння термодинамічної роботи політропного процесу має аналогічний вид з рівнянням термодинамічної роботи адіабатного процесу
 . (4.31)
. (4.31)
Наявна робота політропного процесу по аналогії з адіабатним процесом дорівнює
 .
(4.32)
.
(4.32)
Теплоємність
політропного процесу отримаємо з формули
![]() :
:
![]() . (4.33)
. (4.33)
Зміна питомої внутрішньої енергії і ентальпії газу у політропному процесі визначаються за формулами (4.4) і (4.5).
Кількість теплоти політропного процесу, виходячи з першого закону термодинаміки, дорівнює
![]() , (4.34)
, (4.34)
або
![]() . (4.35)
. (4.35)
Теплоємності основних процесів
отримаємо з рівняння (4.33) при різних
значеннях![]() :
:
ізохорний процес
![]()
![]() ;
;
ізобарний процес
![]()
![]() ;
;
ізотермічний процес
![]()
![]() ;
;
адіабатний процес
![]()
![]() .
.
Значення
![]() у будь-якому політропному процесі можна
знайти з рівняння (4.28),
якщо маємо координати двох точок процесу:
у будь-якому політропному процесі можна
знайти з рівняння (4.28),
якщо маємо координати двох точок процесу:
 отже
отже
 .
(4.36)
.
(4.36)
Зміна ентропії газу у політропному процесі
![]()
або для скінченного процесу
 (4.37)
(4.37)
Характеристикою політропного процесу може бути частка питомої теплоти, яка витрачається на зміну внутрішньої енергії ідеального газу і визначається виразом
![]() .
.
Якісний аналіз процесів
за допомогою p-v
і T-s
діаграм. Політропний
процес у
![]() і
і
![]() координатах зображується деякою кривою,
положення якої залежить від показника
політропи
координатах зображується деякою кривою,
положення якої залежить від показника
політропи
![]() .
Для того, щоб простежити за графіками
політропних процесів при різних значеннях
.
Для того, щоб простежити за графіками
політропних процесів при різних значеннях
![]() у
у
![]() і
і
![]() координатах, у тих самих координатах
зображують графіки основних процесів:
ізохорного, ізобарного, ізотермічного
і адіабатного, за допомогою яких можна
визначити положення політроп, а також
знаки
координатах, у тих самих координатах
зображують графіки основних процесів:
ізохорного, ізобарного, ізотермічного
і адіабатного, за допомогою яких можна
визначити положення політроп, а також
знаки
![]() ,
,
![]() ,
,
![]() ,
,
![]() і
і
![]() у цих процесах. Наприклад, графік
політропного процесу з
у цих процесах. Наприклад, графік
політропного процесу з
![]() проходить між графіками ізотермічного
і адіабатного процесів. Усі процеси
починаються в одній точці (рис. 4.9).
проходить між графіками ізотермічного
і адіабатного процесів. Усі процеси
починаються в одній точці (рис. 4.9).


Рис. 4.9. Графіки політропних процесів у p-v координатах (а) і T-s координатах (б)
Ізохора поділяє поле діаграми на дві області: процеси, які знаходяться правіше ізохори, характеризуються додатною роботою, бо супроводжуються розширенням робочого тіла; для процесів, які знаходяться лівіше ізохори, робота від’ємна.
Процеси, які розташовані правіше і вище адіабати, протікають з підведенням теплоти до робочого тіла, а лівіше і нижче адіабати – з відведенням теплоти.
Для процесів, розміщених над ізотермою, характерно збільшення внутрішньої енергії газу і підвищення температури; процеси, розташовані під ізотермою, супроводжуються зменшенням внутрішньої енергії і температури.
