
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 8 клас
.pdf
ІІ семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 33
тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: ознайомити учнів із загальними способами одержання оксидів, основ, кислот, солей; розвивати навички роботи знавчальноюлітературою;показатинаприкладіодержання різних класів неорганічних сполук узаємозв’язок між будо-
вою, властивостями й одержанням цих речовин.
Тип уроку: комбінований урок засвоєння навичок, формування вмінь і творчого застосування їх на практиці.
Форми роботи: робота з підручником, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
Хід уроку
І. Організація класу
Для організації роботи на уроці учні об’єднуються у вісім груп (по дві групи на кожен клас неорганічних сполук для можливості взаємоконтролю та взаємоперевірки). Кожна група одержує картку-завдання, набір навчальної літератури, аркуш для оформлення результатів.
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
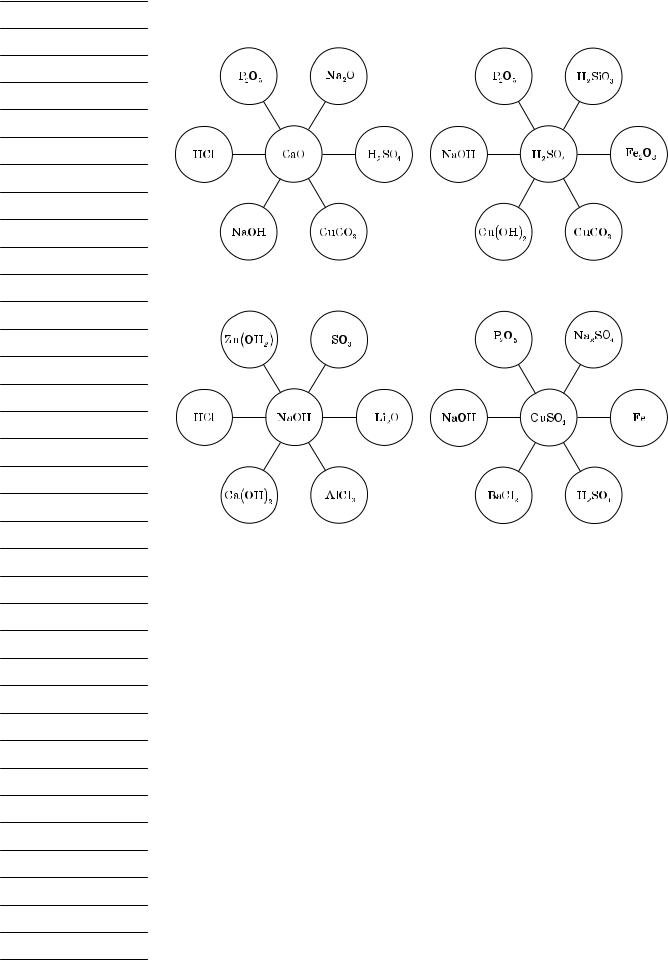
Між класами неорганічних сполук існує генетичний зв’язок. Проаналізуємо, що означає поняття «генетичний зв’язок класів неорганічних сполук».
yy Одні сполуки шляхом хімічних перетворень можна перевести в інші. yy Існує тісний зв’язок між складом окремих класів сполук.
yy Взаємоперетворення кожного класу неорганічних сполук зумовлені їх фізичними й хімічними властивостями.
yy Генетичний зв’язок дає можливість припустити шляхи синтезу класів неорганічних сполук.
Можливе одержання різних класів неорганічних сполук із простих речовин шляхом узаємоперетворення складних речовин.
Сьогодні ми повинні, спираючись на наші знання про властивості класів неорганічних сполук, їх генетичний зв’язок, розглянути способи одержання класів неорганічних сполук. Для цього в запропонованій літературі ви повинні знайти відповіді на певні питання й завдання.
Завдання для груп
Група 1. Розкажіть про способи одержання оксидів у промисловості. Група 2. Розкажіть про лабораторні способи одержання оксидів. Група 3. Розкажіть про способи одержання основ у промисловості. Група 4. Розкажіть про лабораторні способи одержання основ. Група 5. Розкажіть про способи одержання кислот у промисловості. Група 6. Розкажіть про лабораторні способи одержання кислот. Група 7. Розкажіть про способи одержання солей у промисловості. Група 8. Розкажіть про лабораторні способи одержання солей.
ІІІ. Самостійна робота в групах
Учні під керівництвом учителя готують відповіді на завдання групи й вивішують на дошці підготовлені способи одержання класів неорганічних сполук.
Група 1. Загальні способи одержання оксидів у промисловості
1) Багато речовин у природі існують у вигляді руд, що містять оксиди. Напри-
клад: |
|
|
|
|
бурий залізняк Fe2O3; |
|
червоний залізняк Fe3O4; |
|
боксити Al2O3; |
|
пісок, кварц SiO2. |
У цьому випадку одержання оксиду передбачає очищення і збагачення руди.
61

2)Шляхом спалювання простих речовин: N2 +O2 =2NO
3)Шляхом спалювання складних речовин: 4NH3 +5O2 = 4NO +6H2O
Група 2. Лабораторні способи одержання оксидів
1) Шляхом спалювання простих речовин:
C +O2 = CO2 2Mg +O2 =2MgO
(Демонстрація спалювання вуглецю і магнію) 2) Шляхом спалювання складних речовин:
CH4 +2O2 = CO2 +2H2O
3) Шляхом розкладання складних речовин у процесі нагрівання:
Ca(OH)2 = CaO +H2O
H2SO3 = H2O +SO2
CaCO3 = CaO +CO2
Група 3. Одержання основ у промисловості
Луги — шляхом електролізу розчинів солей: 2NaCl+2H2O =2NaOH +H2 +Cl2
Група 4. Лабораторні способи одержання основ
1) Луги — шляхом розчинення лужних і лужноземельних металів у воді: 2Na +2H2O =2NaOH +H2
Луги — шляхом розчинення основних оксидів у воді:
CaO +H2O = Ca(OH)2
2) Нерозчинні основи — шляхом дії лугів на солі: ZnCl2 +2NaOH = Zn(OH)2↓ + 2NaOH
Група 5. Промислові способи одержання кислот
1) Безоксигенові кислоти одержують шляхом розчинення галогеноводнів у воді: HCl, H2S.
2)Виробництво оксигеновмісних кислот — це складний багатостадійний процес, що ґрунтується на розчиненні кислотних оксидів у воді:
SO3 +H2O = H2SO4
CO2 +H2O = H2CO3
Група 6. Лабораторні способи одержання кислот
У лабораторії кислоти одержують шляхом дії більш сильних кислот на розчини солей:
2NaCl+H2SO4 =2HCl ↑ +Na2SO4 CaCO3 +H2SO4 = CaSO4 +CO2 +H2O
Група 7. Одержання солей у промисловості
1)Із природних сполук: CaCO3, Na2CO3, MgCO3, NaCl.
2)Шляхом сплавлення оксидів: Na2O +SiO2 = Na2SiO3
Група 8. Лабораторні способи одержання солей
1)Шляхом узаємодії кислотних оксидів з розчинами лугів: Ca(OH)2 +CO2 =
=CaCO3 +H2O
2)Шляхом розчинення металів у кислотах: Zn +2HCl = ZnCl2 +H2
3)Шляхом узаємодії основних оксидів з кислотами: CaO +H2SO4 = CaSO4 +H2O
4)Шляхом узаємодії основ і кислот: 2NaOH +H2SO4 = Na2SO4 +2H2O
5)Шляхом узаємодії солей з основами: AlCl3 +3NaOH = Al(OH)3↓ + 3NaOH
6)Шляхом узаємодії солей з кислотами: Na2CO3 +2HCl =2NaCl+CO2 +H2O
7)Шляхом узаємодії розчинів солей: AgNO3 +NaCl = AgCl ↓ +NaNO3
IV. Підбиття підсумків уроку
Учитель узагальнює відповіді учнів і підбиває підсумки уроку.
V. Домашнє завдання
Опрацювати відповідний параграф підручника. Скласти схему одержання класів неорганічних сполук у будь-якій формі.
62

ІІ семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 34
тема. Загальні способи одержання оксидів, основ, кислот, солей Цілі уроку: розвивати вміння й навички учнів у складанні рівнянь на прикладі одержання оксидів, основ, кислот, солей; систематизувати знання учнів про загальні способи одержання оксидів, основ, кислот і солей; показати їх узаємозв’язок
з генетичним зв’язком класів неорганічних сполук. Тип уроку: узагальнення й систематизація знань учнів.
Форми роботи: семінар-практикум, демонстраційний експеримент. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
таблиця розчинності, ряд активності металів, лабораторне устаткування, хімічні реактиви.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Мотивація навчальної діяльності
На попередньому уроці ми розглянули способи одержання оксидів, основ, кислот і солей. Удома ви склали схеми способів одержання класів неорганічних сполук.
(Учні презентують свої варіанти класифікації способів одержання класів неорганічних сполук. Учитель коментує й узагальнює.)
Тепер розглянемо, як практично можна використати ці знання.
ІІІ. Практика на прикладах
Демонстрація 11. Взаємодія кальцій оксиду з водою
Насипаємо в пробірку кальцій оксид і доливаємо 10 мл дистильованої води. yy Що спостерігаємо? (Порошок розчинився)
yy Що утворилося в пробірці? (Кальцій гідроксид)
yy Як це можна підтвердити? (Індикатор фенолфталеїн забарвлює розчин у малиновий колір)
Записуємо рівняння хімічної реакції:
CaO +H2O = Ca(OH)2
Тепер пропустимо вуглекислий газ крізь цей розчин. yy Що спостерігаємо? (Випадає осад, забарвлення зникає) yy Чому? (Утворилася сіль)
Записуємо рівняння реакції:
Ca(OH)2 +CO2 = CaCO3↓ + H2O
Завдання 1
Складіть ланцюжок перетворень, що відповідає нашому експерименту. CaO → Ca(OH)2 → CaCO3
Демонстрація 12. Спалювання фосфору
Акуратно, під витяжкою спалюємо 0,5 г червоного фосфору. Одержаний білий порошок розчиняємо в 10–15 мл дистильованої води.
yy Що утворилося в пробірці? (Ортофосфатна кислота)
yy Як це можна перевірити? (З допомогою індикатора. Лакмус забарвлює розчин у рожевий колір)
Запишемо рівняння реакції.
4P +5O2 =2P2O5
P2O5 +3H2O =2H3PO4
Акуратно, по краплях, додаємо розчин натрій гідроксиду до зміни забарвлення розчину з рожевого на фіолетовий.
63

yy Про що свідчить зміна забарвлення? (У пробірці немає кислоти, утворила-
ся сіль)
H3PO4 +3NaOH = Na3PO4 +3H2O
Завдання 2
Складіть схему перетворень, що відповідає цьому експерименту. P → P2O5 → H3PO4 →Na3PO4
Завдання 3
Обчисліть масу натрій фосфату, який можна одержати з фосфору масою: yy варіант І — 6,2 г;
yy варіант ІІ — 15,5 г.
Клас розв’язує задачу та звіряє відповідь.
Завдання 4
Учитель пояснює на уроці, що для одержання солей можна скористатися такими способами:
а) реакція нейтралізації; б) взаємодія кислотних оксидів з основними оксидами;
в) взаємодія кислоти з основним оксидом.
Наведіть конкретні приклади одержання кальцій фосфату кожним із запропонованих способів. Для чого в сільському господарстві використовуються фосфати? Подумайте, солі яких металів найбільш ефективні для використання з цією метою.
Завдання 5
Унаслідок розчинення різних речовин у воді розчин набуває лужного, нейтрального або кислого середовища. Поясніть це і підтвердьте рівняннями хімічних реакцій на нижченаведених прикладах.
а) Які з перелічених речовин — натрій оксид, кальцій, сульфур(IV) оксид — узаємодіють із водою з утворенням лугу?
б) Які з перелічених речовин — калій, барій оксид, сульфур(VI) оксид — узаємодіють із водою з утворенням лугу?
в) Які з перелічених речовин — фосфор(V) оксид, силіцій оксид, сульфур(VI) оксид — узаємодіють із водою з утворенням кислоти?
Учні виконують завдання самостійно по варіантах, з узаємоперевіркою.
IV. Підбиття підсумків уроку
Учитель оцінює роботу учнів і підбиває підсумки уроку.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього.
Творче завдання. Скласти схему одержання сульфатної кислоти із сірки. Обчислити масу одержаної сульфатної кислоти, якщо для реакції взяли сірку масою 128 г.
64

ІІ семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 35
тема. Значення експериментального методу в хімії Цілі уроку: розвиватинавичкийуміннярозв’язуватиекспериментальні
задачі, використовувати знання про властивості речовин різних класів неорганічних сполук для визначення цих речовин; показати значення експерименту в хімічних дослідженнях; повторити правила техніки безпеки.
Тип уроку: формування знань, умінь і навичок.
Форми роботи: самостійна робота, евристична бесіда, лабораторний експеримент.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів.
Демонстрація: індикатори: фенолфталеїн, метиловий оранжевий, лакмус; розчини хлоридної кислоти, натрій хлориду, натрій гідроксиду, аргентум нітрату, барій хлориду, натрій сульфату, натрій карбонату.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання, мотивація навчальної діяльності
Тестова самостійна робота
Варіант І
Завдання 1. Укажіть серед запропонованих речовин формули солей:
а) Na3PO4; |
б) Cu(OH) ; |
в) Na2SiO3; |
г) H2SiO3.2 |
Завдання2.Серед наведених хімічних реакцій укажіть ті, у результаті яких
можна одержати кислоту: |
|
а) Cu +H2SO4 |
б) NaCl+H2SO4 |
в) SO3 +H2O |
г) K2SO4 +H2CO3 |
Завдання 3. Із запропонованих речовин з водою взаємодіють: |
|
а) MgO; |
б) H2SO4; |
в) KNO3; |
г) P2O5. |
Завдання 4. Фенолфталеїн забарвить у малиновий колір розчин: |
|
а) CuSO4; |
б) H3PO4; |
в) NaOH; |
г) NaCl. |
Завдання 5. Напишіть рівняння реакцій, що дозволяють здійснити перетворення:
BaO → Ba(OH)2 → Ba(NO3 )2
Завдання 6. Обчисліть за запропонованою в завданні 5 схемою масу солі, якщо вихідний оксид був узятий кількістю речовини 0,5 моль.
Варіант ІІ
Завдання 1. Укажіть серед запропонованих речовин формули солей:
а) AlCl3; |
б) HCl; |
|
в) Al(OH) ; |
г) Na2ZnO2. |
|
Завдання32.Серед наведених хімічних реакцій укажіть ті, у результаті яких |
||
можна одержати кислоту: |
|
|
а) Na2SiO3 +HCl |
б) SiO2 |
+H2O |
в) Na2SO4 +H2SiO3 |
г) SO2 +H2O |
|
Завдання 3. Із запропонованих речовин з водою взаємодіють: |
||
а) HNO3; |
б) Na2O; |
|
в) NaOH; |
г) SO3. |
|
Завдання 4. Фенолфталеїн забарвить у малиновий колір розчин: |
||
а) Na2SO4; |
б) Ca(OH) ; |
|
в) H2SO3; |
г) KBr. |
2 |
65

Завдання 5. Напишіть рівняння реакцій, що дозволяють здійснити перетворення:
SO3 → H2SO4 →Na2SO4
Завдання 6. Обчисліть за запропонованою в завданні 5 схемою масу солі, якщо вихідний оксид був узятий кількістю речовини 1,5 моль.
ІІІ. Формування знань, умінь і навичок
Евристична бесіда з учнями щодо значення експерименту в здобутті хімічних знань, з історії відкриття деяких законів хімії.
На уроці познайомимося з реакціями, що дозволяють відрізняти одні хімічні речовини від інших. Такі реакції в хімії називаються якісними реакціями.
Лабораторна робота № 10. Розв’язання експериментальних задач
Повторюємо правила роботи з хімічними речовинами, основні правила поведінки в хімічному кабінеті.
Дослід 1
Утри пробірки без написів лаборант налив розчини: натрій хлориду, хлоридної кислоти, натрій гідроксиду. Допоможіть недбалому лаборантові розібратися, в якій пробірці міститься кожна з речовин.
Які реактиви можна використати, щоб розпізнати ці речовини? Індикатори: фенолфталеїн, лакмус, метиловий оранжевий.
Упробірці з натрій хлоридом лакмус не змінить кольору.
Упробірці з хлоридною кислотою змінює колір на червоний.
Упробірці з лугом колір змінюється на синій.
Завдання. Акуратно з допомогою лакмусового папірця дослідіть запропоновані розчини та приклейте відповідні етикетки на пробірки.
Розглянемо наступні три пробірки. У кожній з них міститься сіль: натрій хлорид, натрій сульфат або натрій карбонат. Щоб розпізнати ці речовини, слід скористатися якісними реакціями.
Дослід 2. Якісна реакція на хлоридну кислоту та її солі
Якісною реакцією на хлоридну кислоту та її солі є дія розчину аргентум(I) нітрату.
Завдання. Налийте в пробірку 1 мл натрій хлориду, додайте одну-дві краплі аргентум(I) нітрату. Що спостерігаєте? Випадіння білого осаду. Процес описується рівнянням реакції:
NaCl+AgNO3 → AgCl +NaNO3
бiлий осад
Дослід 3. Якісна реакція на сульфатну кислоту та її солі
Якісна реакція на сульфатну кислоту та її солі — дія розчинних солей Барію. Завдання. Налийте в пробірку 1 мл натрій сульфату, додайте одну-дві краплі барій нітрату. Що спостерігаєте? Випадіння білого осаду. Процес описується
рівнянням реакції:
Na2SO4 +BaCl2 → BaSO4 +2NaCl
бiлий осад
Дослід 3. Якісна реакція на карбонати
Якісна реакція на карбонати — дія кислот.
Завдання.Налийте в пробірку 1 мл натрій карбонату, додайте одну-дві краплі хлоридної кислоти. Що спостерігаєте? Виділення бульбашок газу. Процес описується рівнянням реакції:
Na2CO3 +2HCl →2NaCl+H2O +CO2
ІV. Підбиття підсумків уроку
З допомогою експерименту можна не лише відкривати нові закони, але й визначати вже відомі речовини. За результатами експерименту складемо таблицю (див. Додаток до уроку на с. 67).
V. Домашнє завдання
Опрацювативідповіднийпараграфпідручника,відповістиназапитання,підготуватися до практичної роботи № 2 «Розв’язання експериментальних задач».
66

ІІ семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 36
тема. Практична робота № 2 «Розв’язання експериментальних задач»
Цілі уроку: перевірити знання правил техніки безпеки, навички роботи з лабораторним устаткуванням, хімічними реактивами, навички проведення хімічного експерименту; перевірити навички практичного використання знань про фізичні й хімічні властивості речовин різних класів неорганічних сполук.
Тип уроку: практичне використання знань, умінь і навичок. Форми роботи: практична робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, реактиви й устаткування за інструкцією до практичної роботи № 2.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Повторення правил техніки безпеки в кабінеті хімії, під час проведення хімічного експерименту, інструктування перед початком практичної роботи.
ІІІ. Виконання практичної роботи за інструкцією
IV. Оформлення звіту про виконану роботу в зошитах, формулювання висновків щодо роботи
V. Домашнє завдання
Повторити фізичні й хімічні властивості класів неорганічних сполук, способи їх одержання.
|
|
Додаток до уроку 35 |
|
|
|
Речовина |
Якісна реакція |
Ознаки реакції |
|
|
|
Сульфати |
Дія розчинних солей Барію |
Білий осад BaSO4 |
|
|
|
Хлориди |
Дія аргентум нітрату |
Білий осад AgCl |
|
|
|
|
Дія кислот |
Виділення газу CO2 |
|
|
|
Карбонати |
Гашене вапно |
Білий осад CaCO3 |
|
|
|
Фосфати |
Аргентум нітрат |
Жовтий осад Ag3PO4 |
|
|
|
67
Додаток до уроку 38
Поле 1 |
Поле 2 |
Поле 3 |
Поле 4 |
Додаток до уроку 41
Властивості лужних металів
Характеристики |
Літій |
Натрій |
Калій |
Рубідій |
Цезій |
Францій |
|
|
|
|
|
|
|
Символ |
Li |
Na |
K |
Rb |
Cs |
Fr |
|
|
|
|
|
|
|
Атомна маса |
6,94 |
22,99 |
39,10 |
85,47 |
132,91 |
[223] |
|
|
|
|
|
|
|
Порядковий |
3 |
11 |
19 |
37 |
55 |
87 |
номер |
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентність |
І |
І |
І |
І |
І |
I |
|
|
|
|
|
|
|
Радіус атома, нм |
0,156 |
0,192 |
0,238 |
0,251 |
0,271 |
|
|
|
|
|
|
|
|
Густина, г/см3 |
0,53 |
0,97 |
0,86 |
1,52 |
1,87 |
|
Температура |
179 |
97,8 |
6305 |
39 |
28,5 |
|
плавлення, °С |
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура |
1 340 |
883 |
760 |
696 |
708 |
|
кипіння, °С |
|
|
|
|
|
|
|
|
|
|
|
|
|
Агрегатний стан |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
(н. у.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Колір полум’я |
Червоно- |
Жовтий |
Фіолето- |
Червоний |
Фіолето- |
|
|
коричневий |
|
вий |
|
вий |
|
|
|
|
|
|
|
|
68

ІІ семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 37
тема. Розрахункизахімічнимирівняннямимаси,об’єму,кількості речовини реагентів і продуктів реакції
Цілі уроку: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними; підготувати учнів до тематичного оцінювання.
Тип уроку: узагальнення й систематизація знань, умінь і навичок. Форми роботи: виконання тренувальних вправ, самостійна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, карткизавдання.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Самостійна робота за варіантами Завдання. Заповніть пропуски в таблиці в рядку свого варіанта.
Варі- |
Вихідна |
Про- |
Рів- |
Вихідна речовина |
|
Продукт реакції |
||||||
дукт |
няння |
|
|
|
|
|
|
|
|
|||
ант |
речовина |
M |
m |
V |
ν |
M |
m |
V |
ν |
|||
реакції |
реакції |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
Ca |
Ca(OH)2 |
|
|
|
|
0,5 моль |
|
|
|
|
|
2 |
CH4 |
CO2 |
|
|
|
5 л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Na2CO3 |
NaCl |
|
|
10,6 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
Zn |
H2 |
|
|
|
|
|
|
|
|
0,1 моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
AlCl3 |
Al(OH)3 |
|
|
|
|
|
|
7,8 г |
|
|
|
6 |
MgО |
MgCO3 |
|
|
8 г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
Fe(OH)3 |
Fe2O3 |
|
|
|
|
|
|
|
|
0,4 моль |
|
8 |
S |
SO2 |
|
|
|
|
|
|
|
1,8 л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
CO2 |
CaCO3 |
|
|
|
2 л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IІІ. Засвоєння нових умінь і навичок
Практика на прикладах Завдання 1. Обчисліть кількість речовини води, що виділиться внаслідок
термічного розкладання купрум(II) гідроксиду масою 9,8 г. |
|
||||||||
Дано: |
|
|
Розв’язання |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
m(Cu(OH) |
) = 9,8 г |
1) Складемо рівняння реакції: |
|
|||||
|
M(Cu(OH)2 |
|
) = 98 г моль |
|
Cu(OH)2 → CuO +H2O |
||||
2 |
|
2) Обчислимо кількість речовини Cu(OH)2 за фор- |
|||||||
|
ν(H2O) −? |
|
|
||||||
|
|
|
мулою ν = |
m |
: |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
M |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ν(Cu(OH) ) = |
|
9,8 г |
= 0,1 моль. |
||
|
|
|
|
98 |
г моль |
||||
|
|
|
|
|
|
2 |
|
|
|
3) За рівнянням реакції обчислимо кількість речовини води:
ν(H2O) = 0,1 моль.
Відповідь: 0,1 моль води.
69

Під керівництвом учителя учні розв’язують задачі біля дошки.
Завдання 2. Обчисліть маси вихідних речовин, необхідних для одержання 98 кг сульфатної кислоти.
Дано:
m(H2SO4 ) = 98 кг = 9,8 104 г M(H2SO4 ) = 98 г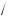 моль
моль
m(SO3 ) −? m(H2O) −?
Розв’язання
1) Запишемо рівняння реакції: SO3 +H2O → H2SO4
2)Обчислимо кількість речовини сульфатної кислоти за формулою ν = Mm :
ν(H2SO4 ) = 9,8 104 г =1000 моль. 98 г моль
моль
3) За рівнянням реакції обчислимо кількість речовини SO3 й H2O:
ν(SO3 ) =1000 моль; ν(H2O) =1000 моль. 4) Обчислимо маси вихідних речовин за формулою ν = Mm :
m(SO3 ) = 80 г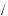 моль 1000 моль = 80 000 г = 80 кг;
моль 1000 моль = 80 000 г = 80 кг;
m(H2O) =18 г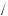 моль 1000 моль =18 000 г =18 кг. Відповідь: 18 кг H2O, 80 кг SO3.
моль 1000 моль =18 000 г =18 кг. Відповідь: 18 кг H2O, 80 кг SO3.
Завдання 3. У результаті взаємодії деякого двовалентного металу масою 11,2 г з розчином хлоридної кислоти виділився водень об’ємом 4,48 л. (н. у.) Визначте цей метал.
Розв’язання
1) Для розв’язання задачі складемо рівняння реакції в загальному вигляді: Me +2HCl → MeCl2 +H2
2) Обчислимо кількість речовини водню за формулою ν = V :
Vm
ν(H2 ) = |
4,48 г |
= 0,2 моль. |
|
22,4 л моль |
|||
|
|
3)За рівнянням реакції обчислимо кількість речовини металу:
ν(Me) = ν(H2 ) = 0,2 моль.
4)Обчислимо молярну масу металу:
M(Me) = |
11,2 г |
=56 г моль. |
|
0,2 моль |
|||
|
|
5)З допомогою періодичної системи знайдемо метал з атомною масою 56 г/моль. Це Ферум.
Відповідь: залізо.
ІV. Закріплення нового матеріалу
Незалежна практика
Учні самостійно розв’язують задачі з наступним обговоренням результату. Завдання 4. Тривалентний метал масою 32,4 г розчинили в сульфатній кислоті. При цьому виділився водень об’ємом 40,32 л (н. у.). Визначте цей метал. Завдання 5. Для відновлення двовалентного металу з оксиду масою 11,15 г
витратили водень об’ємом 1,12 л (н. у.). Визначте цей метал.
Завдання 6*. У розчин аргентум(I) нітрату занурили металеву пластинку. При цьому виділилося 3,4 г срібла, а маса пластинки зменшилася на 6,5 г. Визначте метал, якщо відомо, що він розташований у II групі періодичної системи хімічних елементів.
V. Підбиття підсумків уроку
Учитель підбиває підсумки роботи учнів на уроці, оцінює роботу груп.
VI. Домашнє завдання
Повторити фізичні й хімічні властивості класів неорганічних сполук, способи їх одержання.
70
