
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 8 клас
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 26
тема. Фізичні й хімічні властивості середніх солей Цілі уроку: розширитизнанняучнівпрохімічнівластивостікласівнеор-
ганічних сполук на прикладі властивостей середніх солей; розвиватинавичкийумінняскладаннярівняньхімічнихреакцій на прикладі хімічних властивостей середніх солей.
Тип уроку: поглиблення й систематизація знань.
Форми роботи: розповідь учителя, демонстраційний експеримент, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, розчини реактивів.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання
ІІІ. Мотивація навчальної діяльності
Ми вивчили хімічні властивості оксидів, кислот, основ. За результатами наших досліджень ми склали таблицю взаємодії класів неорганічних сполук. Звернімося до цієї таблиці.
|
Основний оксид |
Кислота |
Основа |
Сіль |
|
|
|
|
|
Кислотний оксид |
+ |
– |
+ |
– |
|
|
|
|
|
Кислота |
+ |
– |
+ |
+ |
|
|
|
|
|
Основа |
– |
+ |
– |
+ |
|
|
|
|
|
Сіль |
– |
+ |
+ |
? |
|
|
|
|
|
З допомогою цієї таблиці й демонстраційного експерименту складемо план вивчення хімічних властивостей солей:
Солі взаємодіють:
1)з кислотами;
2)з основами;
3)із солями.
yy Чи завжди можливі ці реакції? (Ні)
yy В яких випадках реакція відбувається необоротно?
Якщо утворюється нерозчинна речовина;
якщо виділяється газоподібна речовина;
якщо утворюється вода.
Розглянемо властивості солей експериментально.
IV. Демонстрація 10. Хімічні властивості солей
Дослід 1. Взаємодія солей з кислотами
Цю властивість кислот ми вивчали. В якому випадку можлива ця реакція? (Якщо знову утворена кислота слабша за кислоту, що реагувала)
До розчину натрій карбонату додаємо кілька крапель сульфатної кислоти:
K2CO3 +H2SO4 = K2SO4 +H2O +CO2↑
Ознака реакції — виділення газоподібної речовини. Карбонатна кислота, що утворилася, слабша за сульфатну.
Висновок. Солі реагують із кислотами, якщо кислота, яка утворилася, слабша за ту кислоту, що реагувала.
Дослід 2. Взаємодія солей з основами
Ці реакції ми розглядали, вивчаючи властивості лугів.
51

— Які речовини при цьому утворювалися? (Нерозчинні основи)
До розчину алюміній сульфату по краплях додаємо натрій гідроксид. Al2 (SO4 )3 +6NaOH =2Al(OH)3 +3Na2SO4
Висновок. Солі взаємодіють з основами, якщо утворюється нерозчинна сіль або основа.
Дослід 3. Візьмемо дві солі. До натрій сульфату додамо барій хлорид. Спостерігаємо випадіння осаду, отже, відбулася хімічна реакція.
BaCl2 +Na2SO4 = BaSO4↓ + 2NaCl
Звернімося до таблиці розчинності: BaSO4 — нерозчинна сіль.
До натрій сульфату додамо калій карбонат. Видимих ознак реакції немає. Запишемо рівняння реакції:
Na2SO4 (розч.) +K2CO3 (розч.) = K2SO4 (розч.) +Na2CO3 (розч.)
Подивіться в таблиці розчинності. Усі солі розчинні, реакція не протікає. Висновок. Солі взаємодіють між собою, якщо в результаті реакції утворю-
ється нерозчинна сіль. Додаємо «плюс» у таблицю.
Дослід 4. Крім перелічених властивостей солі можуть узаємодіяти з металами. Розглянемо дві пробірки.
Упершу наливаємо розчин купрум(ІІ) сульфату й кидаємо дві гранули цинку.
Удругу наливаємо розчин цинк сульфату й кидаємо два шматки мідного дроту.
Спостерігаємо за обома пробірками. Що відбулося в першій? (На шматоч-
ках цинку з’явився червоний наліт міді) У другій пробірці змін немає.
Звернімося до ряду активності металів. Така реакція можлива, якщо метал, який додається, активніший за той, що входить до складу солі. Запишемо рівняння реакції:
CuSO4 +Zn = Cu+ZnSO4
Cu +ZnSO4 ≠
V. Керована практика
Завдання 1
Учень заради експерименту занурив шматочки металу в розчини кислот. Поясніть, що спостерігатиме учень у кожній пробірці, і підтвердьте свої припущення рівняннями хімічних реакцій:
а) Mg +H2SO4 → |
б) Ag +HCl → |
|
|
|||
в) Al+H2SO4 → |
г) Ca +HCl → |
|
|
|||
д) Ag +H2SO3 → |
е) Cu +H2SO4 → |
|
|
|||
ж) Zn +H3PO4 → |
з) Hg +H2CO3 → |
|
|
|||
Завдання 2 |
|
|
|
|
||
Складіть рівняння можливих реакцій за таблицею: |
|
|
||||
|
|
|
|
|
|
|
|
|
Na2CO3 |
CuSO4 |
Ba(NO3 ) |
PbCl2 |
Na3PO4 |
|
|
|
|
2 |
|
|
I |
Na2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
II |
AgNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
III |
Al2 (SO4 )3 |
|
|
|
|
|
IV |
BaCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
V |
Zn(NO3 ) |
|
|
|
|
|
|
2 |
|
|
|
|
|
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання. Закінчити роботу із завдання 2.
Творче завдання. Підготувати повідомлення про поширення солей у природі та їх практичне значення.
52

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 27
тема. Поширення солей у природі та їх практичне значення Цілі уроку: систематизуватизнанняучнівпрохімічнівластивостікласів
неорганічних сполук на прикладі хімічних властивостей солей; показати поширення солей у природі, їх практичне значення.
Тип уроку: поглиблення й систематизація знань.
Форми роботи: лабораторнаробота,навчальнийміні-семінар,роботазопор- ною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, розчини реактивів.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань учнів
Заповнюємо опорну схему «Хімічні властивості солей». Інструктаж з безпеки життєдіяльності.
ІІІ. Лабораторна робота № 7. Взаємодія солей з металами
Утри пробірки наливаємо по 1 мл розчину купрум(ІІ) сульфату й занурюємо по одній гранулі заліза, алюмінію, цинку.
Унаступні три пробірки наливаємо по 1 мл розчину цинк сульфату й занурюємо по одній гранулі міді, заліза, алюмінію.
— Що спостерігаєте? Заповніть протокол.
Протокол лабораторної роботи № 7
№ досліду |
Реактиви |
|
Що спостері- |
Рівняння |
Висновок |
|
I |
|
II |
гали? |
реакції |
||
|
|
|
||||
|
|
|
|
|
|
|
|
CuSO4 |
|
Fe |
|
|
|
|
|
|
Al |
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
|
|
|
|
|
|
|
|
|
|
|
ZnSO4 |
|
Cu |
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
Al |
|
|
|
|
|
|
|
|
|
|
Чому в графі «Рівняння реакції» у деяких випадках немає запису? (Ряд ак-
тивності)
IV. Лабораторна робота № 8. Взаємодія солей з лугами в розчині
У дві пробірки наливаємо розчини CuSO4 й ZnSO4, потім в обидві пробірки по краплях додаємо натрій гідроксид до появи осаду.
yy Чому до розчину ZnSO4 натрій гідроксид необхідно додавати акуратно, по краплях?
yy А якщо, навпаки, додавати розчин ZnSO4 до розчину натрій гідроксиду? Заповніть протокол лабораторної роботи № 8.
Протокол лабораторної роботи № 8
№ досліду |
Реактиви |
Що спостері- |
Рівняння |
Висновок |
||
гали? |
реакції |
|||||
|
|
|
|
|||
|
|
|
|
|
|
|
|
CuSO4 |
NaOH |
|
|
|
|
|
|
|
|
|
|
|
|
ZnSO4 |
NaOH |
|
|
|
|
|
|
|
|
|
|
|
53

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 28
тема. Практичнаробота№1.Дослідженнявластивостейосновних класів неорганічних сполук
Цілі уроку: продовжити формування навичок роботи з хімічними речовинами й лабораторним устаткуванням; перевірити знання техніки безпеки під час роботи в кабінеті хімії; поглибити знанняпрохімічнівластивостіоксидів,кислот,основісолей; визначити рівень засвоєння знань про хімічні властивості класів неорганічних сполук.
Тип уроку: практичне використання знань, умінь і навичок. Форми роботи: виконання експерименту, складання звіту.
Обладнання: відповідно до інструкції.
Хід уроку
І. Організація класу
ІІ. Повторення правил техніки безпеки в кабінеті хімії, під час проведення хімічного експерименту, інструктування перед початком практичної роботи
ІІІ. Виконання практичної роботи за інструкцією
IV. Оформлення звіту про виконану роботу в зошитах, формулювання висновків щодо роботи
V. Домашнє завдання
Повторити хімічні властивості класів неорганічних сполук.
Додаток до уроку 27
V. Лабораторна робота № 9. Реакція обміну між солями в розчині
Протокол лабораторної роботи № 9
№ досліду |
Реактиви |
Що спостері- |
Рівняння |
Висновок |
||
I |
II |
гали? |
реакції |
|||
|
|
|||||
|
|
|
|
|
|
|
|
CuSO4 |
BaCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
ZnSO4 |
BaCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
AgNO3 |
BaCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
CuSO4 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
В якому випадку ми можемо стверджувати, що реакція не відбувається? Чому?
VI. Міні-семінар
Учні розповідають про практичне застосування солей, їх поширення в природі.
VII. Домашнє завдання
Опрацювати відповідний параграф підручника, підготуватися до практичної роботи № 1 «Дослідження властивостей основних класів неорганічних сполук».
54

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 29
тема. Генетичний зв’язок між класами неорганічних сполук Цілі уроку: розкрити взаємозв’язок явищ у природі на прикладі вза-
ємоперетворень одних класів речовин на інші; узагальнити знанняпронеорганічніречовинитаїхвластивості;розвивати вмінняпорівнюватискладівластивостіречовин,класифікувати речовини й реакції, встановлювати генетичний зв’язок між класами неорганічних сполук.
Тип уроку: поглиблення й узагальнення знань. Форми роботи: виконання вправ, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, опорні схеми класів неорганічних сполук, генетичного зв’язку класів неорганічних сполук.
Хід уроку
І. Організація класу
ІІ. Аналіз виконання практичної роботи
Робота із класом зі з’ясування типових помилок, коригування знань.
ІІІ. Мотивація навчальної діяльності
Повернімося до схеми класифікації речовин.
Усі класи речовин складаються з тих самих хімічних елементів: металів
інеметалів.
—Чим вони відрізняються? Кількісним і якісним складом.
А чи існує зв’язок між окремими класами неорганічних сполук? У чому цей зв’язок виявляється? Речовини одного класу взаємодіють з іншими речовинами. При цьому утворюються сполуки інших класів. Тобто шляхом хімічних перетворень сполуки одного класу можна перетворювати на інші. Ми говоримо, що між класами неорганічних сполук існує генетичний зв’язок, тобто вони взаємоперетворюються під час хімічних реакцій.
Розгляньмо найпростіші приклади.
ІV. Поглиблення знань
Здійсніть перетворення:
S → SO2 → H2SO3 →Na2SO3
1)S +O2 → SO2
2)SO2 +H2O → H2SO3
3)H2SO3 +2NaOH →Na2SO3 +2H2O
Запишемо цю схему в загальному вигляді.
Схема 1
Неметал → кислотний оксид → кислота → сіль
Тепер візьмемо інший ланцюжок перетворень: Na →Na2O →NaOH →Na2SO3
1)4Na +O2 →Na2O
2)Na2O +H2O →2NaOH
3)H2SO3 +2NaOH →Na2SO3 +2H2O
Запишемо її в загальному вигляді.
Схема 2
Метал → основний оксид → основа → сіль
Подібних ланцюжків можна запропонувати багато.
55
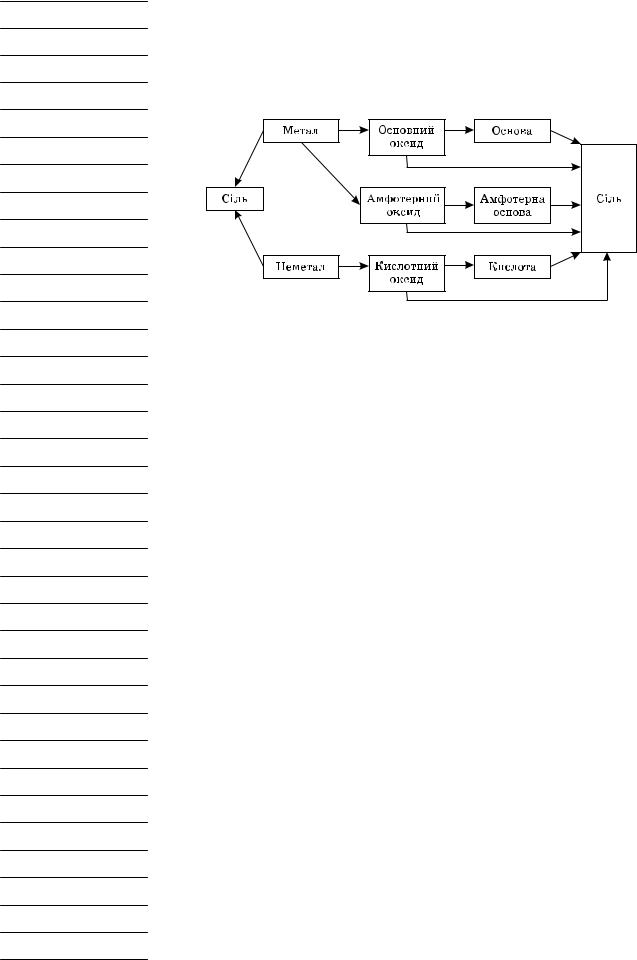
Завдання 1
Запропонуйте ланцюжки перетворень до схем 1 і 2. (Заслуховуємо варіанти учнів, записуємо на дошці.)
Схеми 1 і 2 можуть змінюватися. У загальному вигляді така схема матиме набагато більш складну структуру. Наприклад:
Схема 3 Генетичний зв’язок класів неорганічних сполук
Розглядаємо з учнями схему.
Чи можна одержати сіль з оксиду? Так. Отже, до схеми слід додати стрілочку від оксидів до солі.
Чи можна одержати основу із солі? Так, тобто стрілочки мають бути у двох напрямках.
Аналогічно можна одержати кислоту із солі, оксиди з основ і кислот, чисті метали й неметали з їхніх оксидів і солей і т. д. (Учні аналізують можливі шляхи взаємоперетворень класів неорганічних сполук за схемою і доповнюють схему генетичного зв’язку.)
V. Керована практика
Завдання 2 (по варіантах, під керівництвом учителя)
Напишіть рівняння реакцій, щоб здійснити перетворення.
Варіант І
а) P → P2O5 → H3PO4 →Na3PO4
б) Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnSO4
Варіант ІІ
а) Ca → CaO → Ca(OH)2 → CaCO3
б) Al → Al2O3 → Al2 (SO4 )3 → Al(OH)3 → AlCl3
Зачитуємо правильні відповіді.
Завдання 3
Обчисліть кількість речовини магній сульфату, яку можна одержати з магнію масою 12 г, за схемою:
Mg → MgO → MgSO4
(Відповідь: 0,5 моль)
Завдання 4
Варіант І
Обчисліть кількість речовини натрій ортофосфату, якщо для реакції взяли 6,2 г фосфору.
Варіант ІІ
Обчисліть кількість речовини кальцій карбонату, якщо для реакції взяли кальцій масою 30 г.
VI. Підбиття підсумків уроку
Перевірка відповідей у завданні 4, виставлення оцінок за роботу на уроці.
VII. Домашнє завдання
Опрацювати відповідний параграф підручника, скласти схему 1, 2 для Карбону й Барію.
56

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 30
тема. Генетичний зв’язок між класами неорганічних сполук Цілі уроку: розкрити взаємозв’язок явищ у природі на прикладі вза-
ємоперетворень одних класів речовин на інші; узагальнити знанняпронеорганічніречовинитаїхвластивості;розвивати вмінняпорівнюватискладівластивостіречовин,класифікувати речовини й реакції, встановлювати генетичний зв’язок між класами неорганічних сполук.
Тип уроку: узагальнення й систематизація знань. Форми роботи: самостійна робота, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, опорні схеми, картки-завдання.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Учні записують на дошці підготовлені схеми генетичного зв’язку на прикладі Барію й Карбону, а також рівняння до них.
ІІІ. Фронтальна робота з картками-завданнями
Завдання 1
Унаслідок розчинення різних речовин у воді розчин набуває лужного, нейтрального або кислого середовища. Поясність це і підтвердьте рівняннями хімічних реакцій на таких прикладах:
а) Які з перелічених речовин — натрій оксид, кальцій, сульфур(IV) оксид — узаємодіють із водою з утворенням лугу?
б) Які з перелічених речовин — калій, барій оксид, сульфур(VI) оксид — узаємодіють із водою з утворенням лугу?
в) Які з перелічених речовин — фосфор(V) оксид, силіцій оксид, сульфур(VI) оксид — взаємодіють із водою з утворенням кислоти?
Завдання 2
Поясніть, що означає поняття «генетичний зв’язок». Виберіть правильну відповідь і обґрунтуйте її:
а) перетворення речовин одного класу сполук на речовини інших класів; б) хімічні властивості речовин; в) можливість одержання складних речовин із простих;
г) взаємозв’язок простих і складних речовин усіх класів неорганічних сполук. Складіть схему генетичного зв’язку класів неорганічних сполук на прикла-
ді Сульфуру й Кальцію.
Завдання 3
Розчини деяких солей не можна зберігати в залізному посуді. Які з перелічених речовин — купрум(ІІ) нітрат, натрій нітрат, хлоридна кислота — вступають у реакцію заміщення із залізом?
Складіть відповідні рівняння реакцій. Посудину з яких металів ви порекомендували б використати для зберігання цих розчинів?
Завдання 4
а) Визначте речовину С, що утворюється в результаті перетворень: P → P2O5 +H2O→ A
Ca → CaO +H2O→B
A +B → C
Складіть алгоритм виконання цього завдання біля дошки.
57

б) Використайте запропонований алгоритм для виконання аналогічного завдання: визначте, що є продуктом Х, який утворюється в результаті таких перетворень:
S → SO2 → SO3 +H2O→ A
Ba(OH)2 → CaO +H2O→B
A +B → X
Визначте рівень складності цього завдання.
Завдання по варіантах (зі взаємоперевіркою)
Варіант І
Завдання 5
Із чотирьох елементів — Натрій, Сульфур, Оксиген і Гідроген — складіть формули:
yy однієї основи; yy однієї кислоти;
yy трьох середніх солей.
Як ви вважаєте, які з цих речовин реагуватимуть між собою? Складіть рівняння хімічних реакцій, укажіть їх тип.
Варіант ІІ
Завдання 6
Із чотирьох елементів — Алюміній, Хлор, Оксиген і Гідроген — складіть формули:
yy однієї основи; yy однієї кислоти;
yy однієї середньої солі.
Які з цих речовин, на вашу думку, реагуватимуть між собою? Складіть рівняння хімічних реакцій, укажіть їх тип.
IV. Самостійна робота під контролем учителя з наступним обговоренням біля дошки
Завдання 7
У дві однакові відкриті склянки, що врівноважені на шальках терезів та містять достатню для реакції кількість хлоридної кислоти, внесли однакові за масою наважки цинку і крейди.
Чи збережеться рівновага терезів після закінчення реакції? Відповідь підтвердьте обчисленнями.
Завдання 8
Перетворення Сульфуру «зашифровані» схемою:
+O2 гiдратацiя + Al(OH)3 +NaOH NaOH(надл.)
S → A →Б →B →Г → Д → Е
t°
Розшифруйте речовини А, Б, В, Г, Д, Е; укажіть, до якого класу вони належать. Напишіть рівняння реакцій.
V. Підбиття підсумків уроку
Склад, властивості речовин, їх використання тісно пов’язані одне з одним. Знаючи склад речовини, ми можемо запропонувати шляхи синтезу цієї речовини. Якщо нам відомі властивості цієї речовини, ми можемо легко припустити, з якими речовинами вона реагуватиме, де можна її використати.
VI. Домашнє завдання
Повторити матеріал про класи неорганічних сполук, їх властивості, генетичний зв’язок , підготуватися до контрольної роботи.
Творче завдання. Скласти схему генетичного зв’язку для Феруму, записати рівняння реакцій.
58

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 31
тема. Проміжне оцінювання з теми «Основні класи неорганічних сполук»
Цілі уроку: узагальнитийсистематизуватизнанняучнівпровластивості класів неорганічних сполук, їх генетичний зв’язок; визначити рівень навчальних досягнень з теми.
Тип уроку: проміжний контроль і коригування знань. Форми роботи: письмова контрольна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, карткизавдання.
Хід уроку
І. Організація класу
ІІ. Проведення контрольної роботи
Варіант І
1.Виберіть із переліку речовини, розчини яких забарвлюють фенолфталеїн у малиновий колір:
1) NaOH; |
2) |
Na2SO4; |
3) HCl; |
4) CaCO3. |
|
2. Установіть відповідність: |
|
|
а) кислотний оксид |
1) |
SO3 |
б) основний оксид |
2) |
Na2S |
в) амфотерний оксид |
3) CaО |
|
г) не є оксидом |
4) ZnО |
|
3.Виберіть ряд солей, розчини яких унаслідок узаємодії з розчином NaOH утворюють виключно нерозчинні основи:
1)NaCl, CuCl2, MgCl2;
2)Al2 (SO4 )3 , CuSO4, Na2SO4;
3)AlCl3, CuCl2, MgCl2.
4.Виберіть речовину, що не буде взаємодіяти із сульфатною кислотою:
|
а) Hg; |
б) Na2SO4; |
|
5. |
в) Zn; |
г) Cu(OH)2 . |
|
Допишіть рівняння можливих реакцій: |
|
||
|
1) CO2 +NaOH → |
2) Cu +ZnSO4 |
→ |
|
3) Na2SO4 +H2CO3 → |
4) H2S +KOH |
→ |
6. |
Для нейтралізації хлоридної кислоти кількістю речовини 0,5 моль необхід- |
||
|
но взяти кальцій гідроксид кількістю речовини: |
||
|
а) 0,5 моль; |
б) 0,25 моль; |
|
|
в) 1 моль; |
г) 1,5 моль. |
|
7. |
Здійсніть перетворення: |
|
|
Ca → CaO → Ca(OH)2 → CaCl2
8.Обчисліть об’єм водню (н. у.), що виділиться в результаті дії на розчин сульфатної кислоти алюмінієм масою 2,7 г. (3,36 л)
9.Обчисліть масу ортофосфатної кислоти, яку можна одержати в результаті проведення таких перетворень: фосфор → фосфор(V) оксид → ортофосфатна кислота, якщо фосфор був узятий масою 6,2 г. (19,6 г)
10.Дано ряд речовин:
Ca(NO3 )2 , H2SO4, Ca(OH)2 , SiO2, Са, Al(OH)3 , Hg, CaО, FeSO4, P2O5.
Випишіть речовини, що утворюють генетичний ряд; складіть схему цього зв’язку, напишіть рівняння реакцій, з допомогою яких можна його здійснити.
59

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 32
тема. Аналіз проміжного оцінювання й коригування знань учнів. Підсумковий урок за I семестр
Цілі уроку: узагальнити знання, уміння й навички, набуті під час вивчення теми «Класи неорганічних сполук».
Тип уроку: коригування знань.
Форми роботи: фронтальна робота, індивідуальна робота над помилками. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
таблиця розчинності, ряд активності металів.
Хід уроку
І. Організація класу ІІ. Аналіз тематичного оцінювання
ІІІ. Індивідуальна робота учнів над помилками, виконання коригувальних завдань
IV. Підбиття підсумків, виставлення оцінок за перший семестр
Додаток до уроку 31
Варіант ІІ
1.Виберіть із переліку речовини, розчини яких забарвлюють метиловий оран-
жевий у жовтий колір:
1) H2SO4; 2) H2CO3; 3) NaCl; 4) Ba(OH)2.
2.Установіть відповідність:
а) безоксигенова кислота |
1) |
Cu(OH)2 |
б) оксигеновмісна кислота |
2) HCl |
|
в) сіль |
3) Na2SO4 |
|
г) основа |
4) |
H3PO4 |
3.Виберіть ряд, у якому всі оксиди внаслідок розчинення у воді утворюють луг: 1) Na2O, BaО, K2O; 2) Na2O, Cu2O, N2O; 3) CO, BaО, CaО.
4.Виберіть речовину, що не буде взаємодіяти із сульфатною кислотою:
а) SO2; б) Ag; в) Al; г) Al(OH)3 .
5.Допишіть рівняння можливих реакцій:
1) |
Cu(OH)2 +NaOH → |
2) |
Fe +CuSO4 → |
3) |
BaO +KOH → |
4) |
Zn +HCl → |
6Для нейтралізації сульфатної кислоти кількістю речовини 1 моль необхідно взяти натрій гідроксид кількістю речовини:
а) 1 моль; |
б) 2 моль; |
в) 0,5 моль; |
г) 4 моль. |
7. Здійсніть перетворення: |
|
|
K2O → KOH → KNO3 |
K2SO4
8.Обчисліть масу міді, що виділиться в результаті дії цинкової пластинки на розчин купрум(II) хлориду масою 13,5 г. (6,4 г)
9.Обчисліть масу сульфітної кислоти, що утвориться в результаті проведення таких перетворень: сірка → сульфур(ІV) оксид → сульфітна кислота, якщо для реакції взяли сірку масою 3,2 г. (9,8 г)
10.Дано ряд речовин:
KOH, SO3, KNO3, HNO3, K, FeО, Cu, Na2SO4, Al(OH)3 .
Випишіть речовини, що утворюють генетичний ряд; складіть схему цього зв’язку, напишіть рівняння реакцій, з допомогою яких можна його здійснити.
ІІІ. Домашнє завдання
60
