
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 8 клас
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 10
тема. Контроль рівня навчальних досягнень з теми «Кількість речовини. Розрахунки за хімічними формулами»
Цілі уроку: перевірити рівень знань учнів та їх уміння виконувати розрахунки з використанням понять «кількість речовини», «молярнамаса»,«молярнийоб’єм»,«відноснагустинагазу»; виявити рівень навчальних досягнень учнів з теми.
Тип уроку: контроль знань, умінь і навичок. Форми роботи: письмова контрольна робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, тексти завдань.
Хід уроку
І. Організація класу
ІІ. Письмова контрольна робота
Учитель нагадує учням зміст завдань, час виконання, розподіляє варіанти, наголошує на ключових моментах оформлення відповідей і системи оцінювання: yy завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші
шість завдань — 3 бали;
yy завдання 7–9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань — 9 балів;
yy завдання 10 пропонується виконати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Таким чином, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи — 40 хв.
Варіант І
1.Кількість речовини — це…
2.У кисні O2 кількістю речовини 2 моль міститься:
|
а) 6,02 1023 молекул; |
б) 3,01 1023 |
молекул; |
|
|
в) 12,04 1023 молекул; |
г) 9,03 1023 |
молекул. |
|
3. |
Молярна маса НСl: |
|
|
|
|
а) 36,5 |
г/моль; |
б) 35,5 г/моль; |
|
|
в) 73 г/моль; |
г) 15 г/моль. |
||
4. |
3 моль азоту за н. у. займає об’єм: |
|
|
|
|
а) 67,2 |
л; |
б) 22,4 л; |
|
|
в) 89,6 л; |
г) 44,8 л. |
|
|
5.Одиниця вимірювання молярної маси — …
6.Зв’язок між кількістю речовини й числом молекул описується формулою: …
7. Обчисліть кількість речовини вуглекислого газу CO2 масою 2,2 г. (0,05 моль)
8.Обчисліть відносну густину амоніаку NH3 за воднем H2. (8,5)
9.Обчисліть кількість речовини кисню, що витратиться на згоряння 5 моль кальцію Са. (2,5 моль)
10.Обчисліть, у якій масі карбон(IV) оксиду міститься стільки ж молекул, скільки міститься атомів у фосфорі масою 3,1 г. (1 г)
Варіант ІІ
1.Молярний об’єм — це…
2.У водні кількістю речовини 1,5 моль міститься:
а) 6,02 1023 молекул; |
б) 3,01 1023 |
молекул; |
в) 12,04 1023 молекул; |
г) 9,03 1023 |
молекул. |
21

3. |
Молярна маса СuО: |
|
|
|
а) 64 г/моль; |
б) 16 г/моль; |
|
|
в) 80 г/моль; |
г) 40 |
г/моль. |
4. |
2 моль кисню за н. у. займає об’єм: |
|
|
|
а) 22,4 л/моль; |
б) 44,8 л/моль; |
|
|
в) 11,2 л/моль; |
г) 32 |
л/моль. |
5.Одиниця вимірювання постійної Авогадро — …
6.Зв’язок між кількістю речовини й масою описується формулою: …
7.Обчисліть кількість речовини води масою 3,6 г.
8.Обчисліть відносну густину вуглекислого газу CO2 за киснем.
9.Обчисліть об’єм кисню, що за нормальних умов узаємодіє з воднем об’ємом
3 л.
10.Обчисліть, у якій масі водню міститься стільки ж молекул, скільки міститься атомів у залізі масою 28 г. (1 г)
Варіант ІІІ
1.Молярна маса — це…
2.В азоті кількістю речовини 0,5 моль міститься:
|
а) 6,02 1023 молекул; |
б) 3,01 1023 |
молекул; |
|
в) 12,04 1023 молекул; |
г) 9,03 1023 |
молекул. |
3. |
Молярна маса CO2 : |
|
|
|
а) 22 г/моль; |
б) 32 г/моль; |
|
|
в) 44 г/моль; |
г) 12 г/моль. |
|
4. |
4 моль водню за н. у. займає об’єм: |
|
|
|
а) 44,8 л/моль; |
б) 89,6 л/моль; |
|
|
в) 22,4 л/моль; |
г) 67,2 л/моль. |
|
5.Одиниця вимірювання кількості речовини — …
6.Зв’язок між кількістю речовини й об’ємом газоподібних речовин описується формулою: …
7.Обчисліть кількість речовини натрій хлориду NaCl масою 17,5 г. (0,3 моль)
8.Обчисліть відносну густину сірководню H2S за азотом. (1,21)
9.Обчисліть кількість речовини водню, що взаємодіє без залишку з киснем кількістю речовини 4 моль. (8 моль)
10.Обчисліть, у якій масі азоту N2 міститься стільки ж молекул, скільки міститься атомів у кальції масою 80 г. (56 г)
22

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Тема 2. Основні класи неорганічних сполук
Урок 11
тема. Основні класи неорганічних сполук Мета уроку: сформуватиуявленняпрозагальнукласифікаціюнеорганіч-
них речовин на підставі отриманих раніше знань про прості та складні речовини.
Тип уроку: комбінований.
Форми роботи: бесіда, робота з опорною схемою, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва,
опорна схема, класифікація речовин, навчальна таблиця.
Хід уроку
І. Організація класу
ІІ. Аналіз контрольної роботи
Робота з класом зі з’ясування типових помилок, індивідуальна робота над помилками.
ІІІ. Актуалізація опорних знань, постановка завдання
Бесіда
1.На які два класи поділяються всі хімічні речовини? Наведіть приклади з на-
вчальної таблиці. (Учні називають і деякі пишуть на дошці.)
2.Прості речовини, у свою чергу, поділяються ще на дві групи. Які саме? (Ме-
тали й неметали. Наведені на дошці прості речовини розподіляємо на метали й неметали)
3.А на які групи можна розподілити складні речовини? (З наведених на дошці вибираємо органічні й неорганічні)
4.Складних чи простих речовин більше в природі? (Складних, тому що вони складаються з атомів кількох хімічних елементів, а такі, як органічні, — з різної кількості тих самих елементів: CH4, C2H8 та ін.)
5.А за якою ознакою можна класифікувати складні речовини? (За складом,
будовою, застосуванням, властивостями)
Сьогодні ми починаємо вивчати нову тему, що познайомить вас не лише зі способами класифікації складних речовин, але й дозволить дізнатися, як склад і будова речовин впливають на їхні властивості, способи одержання й застосування.
IV. Вивчення нового матеріалу
Робота з опорною схемою
За складом неорганічні сполуки поділяються на чотири класи: оксиди, основи, кислоти, солі.
Згадайте, де ми зустрічалися з оксидами в процесі вивчення хімії.
У 7 класі під час вивчення простої речовини кисню. Унаслідок згоряння різних речовин у кисні утворюється продукт їх узаємодії — оксид. Тому невід’ємна частина будь-якого оксиду — Оксиген.
Оксиди — це складні речовини, що складаються з атомів двох хімічних елементів, один із яких — Оксиген.
Наводимо приклади оксидів з навчальної таблиці.
Основи — це складні речовини, що складаються з атомів металів та однієї чи кількох гідроксильних груп −OH.
Наприклад: Ca(OH)2 , Mg(OH)2 , NaOH, Fe(OH)3 .
23

Кислоти—цескладніречовини,щоскладаютьсязатомівГідрогенуйкислот- них залишків. (Гідроген у кислотах записується перед кислотним залишком.)
Наприклад: HNO3, H2SO4, H3PO4, H2SO3.
Солі — складні речовини, що складаються з атомів металів і кислотних залишків.
Наприклад: K2SO4, CuSO4, MgSO4.
V. Закріплення вивченого матеріалу
1.Виберіть із п’ятого ряду таблиці формули оксидів.
2.Виберіть зі стовпця В усі формули основ.
3.Виберіть із восьмого ряду формули кислот.
4.Зі стовпця Г виберіть формули солей і відокремте кислотний залишок.
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання.
Навчальна таблиця 1 до уроку 11
№ з/п |
А |
Б |
В |
Г |
Д |
Е |
|
|
|
|
|
|
|
1 |
S |
P |
K2SO4 |
CO |
FeCl2 |
CO2 |
|
|
|
|
|
|
|
2 |
HNO3 |
Li |
Ag2O |
CuSO4 |
H2SO4 |
CaO |
|
|
|
|
|
|
|
3 |
NaCl |
Ca(OH)2 |
Sr(OH)2 |
Na2SiO3 |
Hg |
HgO |
4 |
C4H10 |
H2SO3 |
Mg |
FeCl3 |
C6H12O6 |
Al2O3 |
5 |
K2O |
Na2O |
ZnO |
BaCl2 |
FeS |
SnO2 |
|
|
|
|
|
|
|
6 |
FeS2 |
Fe |
BaSO3 |
C3H8 |
N2 |
LiOH |
|
|
|
|
|
|
|
7 |
K3PO4 |
MgSO4 |
P2O5 |
Cu(OH)2 |
Rb |
SnF4 |
8 |
Br2 |
Cl2O7 |
NaCl |
HI |
KMnO4 |
H3PO4 |
|
|
|
|
|
|
|
9 |
Fe(OH)3 |
Cr2O3 |
Ca |
PbS |
Mg(OH)2 |
CaCO3 |
10 |
LiCl |
K2ZnO2 |
Fe2O3 |
AgCl |
N2O5 |
Cl2 |
|
|
|
|
|
|
|
11 |
HF |
H2S |
NaOH |
O2 |
FeO |
SrSO4 |
|
|
|
|
|
|
|
12 |
ZnS |
Ca3P2 |
Al4C3 |
CH4 |
Mn |
Fe2O3 |
|
|
|
|
|
|
|
24

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 12
тема. Оксиди, їх склад і назви. Класифікація оксидів Цілі уроку: розширити знання про класифікацію неорганічних речовин
на прикладі оксидів та їх класифікації за складом; ознайомити із сучасною науковою українською номенклатурою оксидів;формуватинавичкивикористанняноменклатурина прикладіназвоксидів;розвиватинавичкиучнівускладанні формул бінарних сполук на прикладі складання формул оксидів.
Тип уроку: поглиблення знань.
Форми роботи: робота з опорною схемою, розповідь учителя, демонстраційний експеримент.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, зразки оксидів, навчальна таблиця 2.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань, перевірка домашнього завдання
1.Самостійна робота за варіантами.
Завдання: за навчальною таблицею розподілити по класах речовини, що розташовані в колонці вашого варіанта.
2.По одному учню з різних варіантів пишуть на дошці оксиди.
3.Які сполуки називаються оксидами? (Визначення)
4.Що спільного в складі всіх оксидів, написаних на дошці? (Наявність у скла-
ді атомів Оксигену)
5.Чим відрізняються ці оксиди? (Кількістю атомів Оксигену, другим хімічним елементом, що може бути металом і неметалом)
6.Розподіліть написані на дошці оксиди на оксиди металів і оксиди неметалів.
ІІІ. Вивчення нового матеріалу
Демонстраційний дослід 1. Зразки оксидів
Учні розглядають оксиди в запаяних ампулах, на яких написані формули оксидів та їх назви, розділяють їх на три класи.
Оксиди металів (основні) |
Оксиди неметалів (кислотні) |
Амфотерні оксиди |
|
|
|
CaO, CuO, FeO, K2O |
SiO2, P2O5, SO2 |
Al2O3, ZnO, Fe2O3 |
|
|
|
Оксиди металів — основні оксиди. Оксиди неметалів — кислотні оксиди.
Амфотерні оксиди — це оксиди, що проявляють властивості й кислотних, і основних оксидів.
Назви оксидів за сучасною українською номенклатурою складаються за схемою:
Назва елемента (валентність, якщо вона змінна) + Оксид. Наприклад: CaО — кальцій оксид, SiO2 — силіцій оксид.
Далі по ланцюжку учні називають оксиди, написані на дошці: yy барій оксид;
yy фосфор(V) оксид; yy ферум(II) оксид; yy сульфур(IV) оксид; yy калій оксид;
yy сульфур(VI) оксид.
25

IV. Закріплення знань
Заповнюємо таблицю самостійно в зошиті й коментуємо запис на дошці.
Елемент |
Формула оксиду |
Назва оксиду |
Клас оксиду |
|
|
|
|
Li |
|
|
|
|
|
|
|
C(IV) |
|
|
|
|
|
|
|
Mg |
|
|
|
|
|
|
|
N(III) |
|
|
|
|
|
|
|
Pb(II) |
|
|
|
|
|
|
|
Fe(III) |
|
|
|
|
|
|
|
Cl(VII) |
|
|
|
|
|
|
|
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання, виконати вправи.
Творче завдання. Скласти формули оксидів елементів ІII періоду з вищою валентністю, дати назви, зазначити клас.
Навчальна таблиця 2 до уроку 12
№ з/п |
|
|
Варіант |
|
|
|
|
|
|
|
|
І |
ІІ |
|
ІІІ |
IV |
|
|
|
||||
|
|
|
|
|
|
1 |
Ca(NO3 )2 |
S |
|
KOH |
P2O5 |
2 |
H2SO4 |
Zn(OH)2 |
|
SO3 |
CaO |
3 |
Ca(OH)2 |
Na2SO3 |
|
KNO3 |
CuSO4 |
4 |
SiO2 |
BaO |
|
HNO3 |
P |
|
|
|
|
|
|
5 |
Al(OH)3 |
KOH |
|
K |
Zn(OH)2 |
6 |
Hg |
H2SO3 |
|
Na2SO4 |
Ag |
|
|
|
|
|
|
7 |
CaO |
Na |
|
FeO |
H3PO4 |
|
|
|
|
|
|
8 |
FeSO4 |
BaCl2 |
|
Cu |
NaOH |
|
|
|
|
|
|
9 |
P2O5 |
Cu |
|
Al(OH)3 |
Ba |
10 |
Ca |
SO2 |
|
K2O |
Na3PO4 |
|
|
|
|
|
|
26

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 13
тема. Кислоти, їх склад і назви. Класифікація кислот Цілі уроку: розширити знання про класифікацію неорганічних речовин
на прикладі кислот; ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот.
Тип уроку: поглиблення знань, вивчення нового матеріалу.
Форми роботи: робота з опорною схемою, розповідь учителя, демонстраційний експеримент.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця назв кислот за українською сучасною номенклатурою.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання
Учні пишуть на дошці формули вищих оксидів елементів III періоду, дають назви й указують клас оксиду.
— Як у періоді зі збільшенням порядкового номера хімічних елементів змінюється клас оксидів, які вони утворюють? (Основні →амфотерні →кислотні)
ІІІ. Вивчення нового матеріалу
Кожному кислотному оксиду відповідає кислота.
— Який клас неорганічних речовин називається кислотами?
Демонстраційний дослід 2. Зразки кислот
Розглядаємо зразки кислот у пробірках з етикетками з формулами й назвами. yy Що спільного у формулах кислот, які є у вас на столах? (Атом Гідрогену
присутній у всіх формулах)
yy За кількістю атомів Гідрогену кислоти класифікують на такі класи:
одноосновні (HCl, HNO3 );
двоосновні (H2SO4 );
триосновні (H3PO4 ).
yy Чим відрізняються формули цих кислот?
Кількістю атомів Гідрогену;
наявністю або відсутністю атомів Оксигену.
yy За наявністю Оксигену в складі кислоти поділяються на такі класи:
безоксигенові (HCl);
оксигеновмісні (HNO3, H2SO4, H3PO4 ).
Познайомимося з назвами кислот за сучасною українською номенклатурою. (Розглядаємо таблицю з назвами кислот.) У деяких кислот є історично сформовані назви, що використовуються поряд з номенклатурними дотепер.
Назви кислот
Формула |
Назва |
Тривіальна назва |
Назва кислотного |
|
за номенклатурою |
залишку |
|||
|
|
|||
|
|
|
|
|
HF |
Флуоридна |
Флуороводнева, плавикова |
Флуорид |
|
|
|
|
|
|
HCl |
Хлоридна |
Хлорводнева, соляна |
Хлорид |
|
|
|
|
|
|
HBr |
Бромідна |
Бромводнева |
Бромід |
|
|
|
|
|
|
HI |
Іодидна |
Іодоводнева |
Іодид |
|
|
|
|
|
|
HCN |
Ціанідна |
Ціановоднева |
Ціанід |
|
|
|
|
|
|
H2S |
Сульфідна |
Сірководнева |
Сульфід |
|
|
|
|
|
|
H2SO4 |
Сульфатна |
Сірчана |
Сульфат |
|
|
|
|
|
27

Формула |
Назва |
Тривіальна назва |
Назва кислотного |
|
за номенклатурою |
залишку |
|||
|
|
|||
|
|
|
|
|
H2SO3 |
Сульфітна |
Сірчиста |
Сульфіт |
|
|
|
|
|
|
HNO3 |
Нітратна |
Азотна |
Нітрат |
|
|
|
|
|
|
HNO2 |
Нітритна |
Азотиста |
Нітрит |
|
|
|
|
|
|
H2CO3 |
Карбонатна |
Вугільна |
Карбонат |
|
|
|
|
|
|
H2SiO3 |
Силікатна |
Кремнієва |
Силікат |
|
|
|
|
|
|
H3PO4 |
Ортофосфатна |
Ортофосфорна |
Ортофосфат |
|
|
|
|
|
|
HPO3 |
Метафосфатна |
Метафосфорна |
Метафосфат |
|
|
|
|
|
HCl — хлоридна (соляна) кислота — кислота, що входить до складу шлункового соку.
H2SO4 — сульфатна (сірчана).
HNO3 — нітратна (азотна).
HF — флуоридна (плавикова) кислота, що розчиняє скло.
Назви кислотних залишків відповідають назвам кислот. (Розглядаємо відповідний стовпчик у таблиці.)
I |
I |
II |
III |
H Cl HNO3 H2 SO4 H3 PO4
Кислотний
залишок
Валентність кислотного залишку дорівнює числу атомів Гідрогену в молекулі кислоти.
Чому? (Тому що валентність Гідрогену завжди дорівнює I)
IV. Закріплення вивченого матеріалу
1.Обчисліть масову частку Гідрогену в наведених на дошці кислотах і виберіть кислоту з найбільшим та з найменшим умістом Гідрогену.
ω(H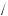 HCl) =1
HCl) =1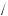 36,5 =2,7 %
36,5 =2,7 %
ω(H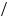 HNO3 ) =1
HNO3 ) =1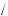 63 =1,6 % — мінімальний уміст
63 =1,6 % — мінімальний уміст
ω(H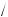 H2SO4 ) =2
H2SO4 ) =2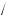 98 =2,0 %
98 =2,0 %
ω(H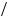 H3PO4 ) =3
H3PO4 ) =3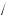 98 = 3,0 % — максимальний уміст
98 = 3,0 % — максимальний уміст
2.Кожній оксигеновмісній кислоті відповідає кислотний оксид, з якого можна одержати цю кислоту. Спробуймо підібрати ці оксиди:
H2SO4 HNO3
H2SO3 H3PO4
SO3
N2O5
SO2
P2O5
3.Для того щоб зрозуміти, як розміщуються атоми в молекулах кислот, будуємо їхні структурні формули.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього.
Вивчити назви кислот за сучасною українською номенклатурою.
28

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 14
тема. Солі (середні), їх склад і назви Цілі уроку: розширити знання про класифікацію неорганічних речовин
і номенклатуру неорганічних речовин на прикладі солей; навчити називати солі, складати їхні формули за валентностями, розпізнавати з-поміж інших класів неорганічних сполук; розвивати вміння й навички складати формули за валентністю на прикладі солей, виконувати обчислення.
Тип уроку: комбінований.
Форми роботи: робота з опорною схемою, розповідь учителя, демонстраційний експеримент, групова робота.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, зразки солей, картки-завдання.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання
Хімічний диктант за назвами кислот і оксидів
1)Купрум(ІІ) оксид;
2)сульфатна кислота;
3)соляна кислота;
4)карбон(ІV) оксид;
5)алюміній оксид;
6)карбонатна кислота;
7)ортофосфатна кислота;
8)сульфатна кислота;
9)ферум(ІІІ) оксид;
10)нітратна кислота.
ІІІ. Мотивація навчальної діяльності, виклад нового матеріалу
Демонстрація 9. Зразки солей
1)NaCl — кухонна сіль
2)CuSO4 — мідний купорос
3)Na2SO4 — каустична сода
4)KMnO4 — марганцівка
5)KNO3 — калійна селітра
(На склянках наведені тривіальні назви.)
— Де використовуються ці солі?
1.Які неорганічні сполуки належать до класу солей?
Солі, представлені на столі, належать до класу середні солі.
Розрізняють: середні (Na2CO3 ), кислі (NaHCO3 ) й основні ((CuOH)2 CO3 ) солі.
2.Як називаються солі відповідно до сучасної української номенклатури? Назва металу (валентність, якщо змінна) + назва кислотного залишку. Скористаймося таблицею «Назви кислот» і назвемо солі, які є на вашому столі.
1) NaCl — натрій хлорид
2) CuSO4 — купрум(ІІ) сульфат
3) Na2SO4 — натрій сульфат
4) KMnO4 — калій перманганат
5) KNO3 — калій нітрат
29

3.Аналогічно можна скласти формули солей, знаючи їхню назву, валентність металу й валентність кислотного залишку.
Ферум(II) хлорид — FeCl2 Натрій фосфат — Na3PO4 Алюміній сульфат — Al2 (SO4 )3
IV. Закріплення вивченого матеріалу
Робота в парах
Кожна пара одержує картку-завдання.
1.Складіть формули солей.
2.Дайте назву за сучасною українською номенклатурою.
|
Cl |
SO4 |
PO4 |
Mg |
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
Fe(III) |
|
|
|
|
|
|
|
|
|
|
|
|
Br |
SO3 |
NO3 |
Cr(III) |
|
|
|
|
|
|
|
Li |
|
|
|
|
|
|
|
Ca |
|
|
|
|
|
|
|
|
|
|
|
|
F |
PO4 |
SiO3 |
Fe(II) |
|
|
|
|
|
|
|
Na |
|
|
|
|
|
|
|
Al |
|
|
|
|
|
|
|
|
|
|
|
|
CO2 |
Cl |
NO3 |
Cu(II) |
|
|
|
|
|
|
|
Li |
|
|
|
|
|
|
|
Al |
|
|
|
|
|
|
|
Учні по черзі читають складені формули солей, записують у зошитах і, за необхідності, на дошці, дають солям назви.
3.Додаткове завдання.
1)Серед одержаних солей виберіть формулу солі з найбільшою молярною масою.
2)Обчисліть кількість речовини в 32 г цієї солі.
3)Обчисліть, у якій масі міститься 2 моль солі.
V. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього.
Творче завдання
1.Складіть формули солей Калію з усіма кислотними залишками в таблиці й дайте їм назви.
2.Підберіть приклади історично сформованих назв солей.
30
