
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 9 класу
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 57
Тема уроку. Білки
Цілі уроку: формуватипоняттяпробілкиякприродніполімери,первинну, вторинну, третинну й четвертинну структури білкових молекул;ознайомитиучнівзфізичнимийхімічнимивластивостямибілківнаприкладігідролізуй денатурації;показати кольорові реакції білків як якісні реакції на білки.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: евристичнабесіда,розповідьучителя,демонстраційнийексперимент.
Обладнання: мультимедійна схема структури білкової молекули. Демонстрація 17. Денатурація білків. Демонстрація 18. Кольорові реакції білків.
Лабораторний дослід 14. Розчинення й осадження білків.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
Фронтальна бесіда
1) Які функціональні групи входять до складу амінокислот? 2) Складіть схему одержання амінооцтової кислоти з метану.
Самостійно виберіть із таблиці три амінокислоти та складіть формули утворених ними трипептидів.
ІІІ. Вивчення нового матеріалу
Білки — природні полімери
1. Будова білкової макромолекули
Розповідь учителя
Білки (поліпептиди) — природні високомолекулярні нітрогеновмісні органічні сполуки, побудовані із залишків α-амінокислот, з’єднаних пептидними зв’язками.
Формальне утворення білкової макромолекули можна представити як реакцію поліконденсації α-амінокислот:
Під час взаємодії двох молекул α-амінокислот відбувається реакція між аміногрупою однієї молекули й карбоксильною групою іншої. Це приводить до утворення дипептиду, наприклад:
111

Із трьох молекул α-амінокислот (гліцин + аланін + гліцин) можна одержати трипептид:
H2N −CH2CO −NH −CH(CH3 )−CO −NH −CH2COOH
Аналогічно відбувається утворення тетра-, пента- і поліпептидів. Молекулярні маси різних білків (поліпептидів) становлять від 10 тисяч
до кількох мільйонів. Макромолекули білків мають стереорегулярну будову, винятково важливу для прояву ними певних біологічних властивостей. Незважаючи на численність білків, до їх складу входять залишки не більш ніж 22 α-амінокислот.
Різноманітні функції білків визначаються α-амінокислотним складом і будовою їх високоорганізованих макромолекул.
Виокремлюють чотири рівні структурної організації білків.
Первинна структура — певна послідовність α-амінокислотних залишків у поліпептидному ланцюзі.
Вторинна структура — це конформація поліпептидного ланцюга, закріп лена численними водневими зв’язками між групами N −H і C = O. Одна з моделей вторинної структури — α-спіраль.
Третинна структура — форма закрученої спіралі в просторі, утвореної в основному за рахунок дисульфідних містків −S −S−, водневих зв’язків, гідрофобних та йонних взаємодій.
Четвертинна структура — агрегати кількох білкових макромолекул (білкові комплекси), утворені за рахунок взаємодії різних поліпептидних зв’язків.
2. Хімічні властивості білків
1) Гідроліз білків полягає в гідролізі поліпептидного ланцюга з утворенням набору амінокислот, які утворюють цей поліпептидний ланцюг.
2) Демонстрація 17. Денатурація білків Денатурація — руйнування третинної та вторинної структур білкової моле-
кули під дією нагрівання, сильних кислот, лугів, солей важких металів, спиртів, радіації.
На прикладі яєчного білка демонструємо денатурацію в процесі нагрівання, під дією сульфатної кислоти, натрій гідроксиду, спирту.
3) Демонстрація 18. Кольорові реакції білків Для білків характерні кольорові реакції, з допомогою яких проводять якіс-
ний хімічний аналіз білків.
yy Біуретова реакція — дія на білок розчину лугу й розчину купрум(II) сульфату. Розчин набуває фіолетового забарвлення, що вказує на наявність поліпептидних зв’язків.
yy Ксантопротеїнова реакція (для білків, що містять бензольне кільце) — дія концентрованої нітратної кислоти з появою жовтого забарвлення. Унаслідок додавання лугу жовте забарвлення змінюється на оранжеве.
yy Цистеїнова реакція (для білків, що містять Сульфур) — кип’ятіння розчину білка із плюмбум(II) ацетатом до появи чорного забарвлення.
IV. Первинне застосування одержаних знань
Лабораторна робота 14. Розчинення й осадження білків Зробіть висновок про умови денатурації білка.
V. Підбиття підсумків уроку
Функції білків у природі універсальні: yy каталітичні (ферменти);
yy регуляторні (гормони);
yy структурні (кератин шерсті, фіброїн шовку, колаген); yy рухові (актин, міозин);
yy транспортні (гемоглобін);
yy запасні (казеїн, яєчний альбумін); yy захисні (імуноглобуліни) тощо.
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
VI. Домашнє завдання
112

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 58
Тема уроку. Нуклеїнові кислоти. Біологічна роль нуклеїнових кислот Цілі уроку: формувати знання учнів про нуклеїнові кислоти як найваж-
ливіші сполуки, що зумовлюють існування всіх живих організмів; ознайомити учнів зі складом і будовою нуклеїнових кислот; формувати уявлення про матеріальну єдність світу, діалектичні уявлення про організацію речовини від простої до складної на прикладі нуклеїнових кислот; показати біологічну роль нуклеїнових кислот.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: евристична бесіда, розповідь учителя.
Обладнання: мультимедійна схема структури нуклеїнових кислот.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Заслуховування повідомлень учнів про біологічну роль і значення білків
2. Фронтальна бесіда
1) Які групи атомів і типи зв’язків найбільш характерні для більшості білкових молекул?
2) Яка структура зумовлює специфічну біологічну активність білкової молекули?
3) Що називають денатурацією білків?
4) Які якісні реакції використовують для визначення білків?
ІІІ. Вивчення нового матеріалу
Нуклеїнові кислоти
Розповідь учителя
Нуклеїнові кислоти — найважливіші органічні сполуки, які зумовлюють можливість існування й розвитку всіх живих організмів. Вони відіграють головну роль у зберіганні й реалізації генетичної інформації.
Нуклеотиди — структурні ланки нуклеїнових кислот — містять три складові:
yy азотисту основу — піримідинову або пуринову; yy моносахарид — рибозу або 2-дезоксирибозу; yy залишок фосфатної кислоти.
У молекулах ДНК наявні чотири основні типи нітрогеновмісних основ: аденін, гуанін, цитозин і тимін. До складу РНК замість тиміну входить подібний до нього за будовою урацил.
Нуклеотиди, з’єднуючись один з одним, утворюють полінуклеотидний ланцюг. Молекули РНК складаються з одного такого ланцюга, а молекули ДНК — із двох полінуклеотидних ланцюжків.
МакромолекулаДНКявляєсобоюдвапаралельнінерозгалуженіполінуклео тидні ланцюги, закручені навколо загальної осі в подвійну спіраль.
Така просторова структура містить безліч водневих зв’язків, утворених азотистими основами, спрямованими всередину спіралі.
Водневі зв’язки виникають між пуриновою основою одного ланцюга й піримідиновою основою іншого ланцюга. Ці основи складають комплементарні пари (від лат. complementum — «доповнення»).
Водневі зв’язки між іншими парами основ не дозволяють їм розміститися в структурі подвійної спіралі.
113

Отже,
yy тимін (Т) комплементарний аденіну (А), yy цитозин (Ц) комплементарний гуаніну (Г).
Здатність ДНК не лише зберігати, але й використовувати генетичну інформацію визначається такими її властивостями:
yy молекули ДНК здатні до реплікації (подвоєння), тобто можуть забезпечити можливість синтезу інших молекул ДНК, ідентичних початковим;
yy молекули ДНК можуть абсолютно точно й певним чином спрямовувати синтез білків, специфічних для організмів певного виду.
IV. Підбиття підсумків уроку
В організмі людини міститься величезна кількість білків, кожен з яких виконує специфічну функцію. При цьому функціональні можливості та спеціалізація кожного з них визначається будовою та розташуванням у їхніх молекулах амінокислот. Інформація про амінокислотну послідовність кожного білка, що синтезується в організмі, закодована в молекулах ДНК.
Нуклеїнові кислоти — головні дійові особи в синтезі білків. Усе, що необхідно клітині для життя, запрограмовано на ділянках молекул ДНК — генах. Записана в генах інформація реалізується молекулами РНК. На молекулі ДНК синтезується молекула інформаційної РНК. На молекулі інформаційної РНК, як на матриці, синтезується молекула певного білка, а окремі молекули амінокислот для синтезу постачаються транспортною РНК.
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання. Підготувати повідомлення про значення нуклеїнових кислот, шляхи синтезу білків.
114

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 59
Тема уроку. Природні й синтетичні органічні речовини Цілі уроку: узагальнитизнанняучнівпроорганічніречовиниприродно-
го походження; показати значення штучних і синтетичних органічних речовин, можливість їх одержання з природних органічних і неорганічних речовин; розкрити значення органічної хімії, причини різноманіття органічних речовин.
Тип уроку: застосування знань, умінь і навичок. Форми роботи: евристична бесіда, групова робота.
Обладнання: зразки природних, штучних і синтетичних сполук, схема класифікації органічних сполук.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Заслуховування повідомлень учнів про біологічну роль і значення нуклеїнових кислот
2. Фронтальне опитування
1) Назвіть природні полімери, які ви знаєте з курсу хімії та біології. Де в природі трапляються ці полімери?
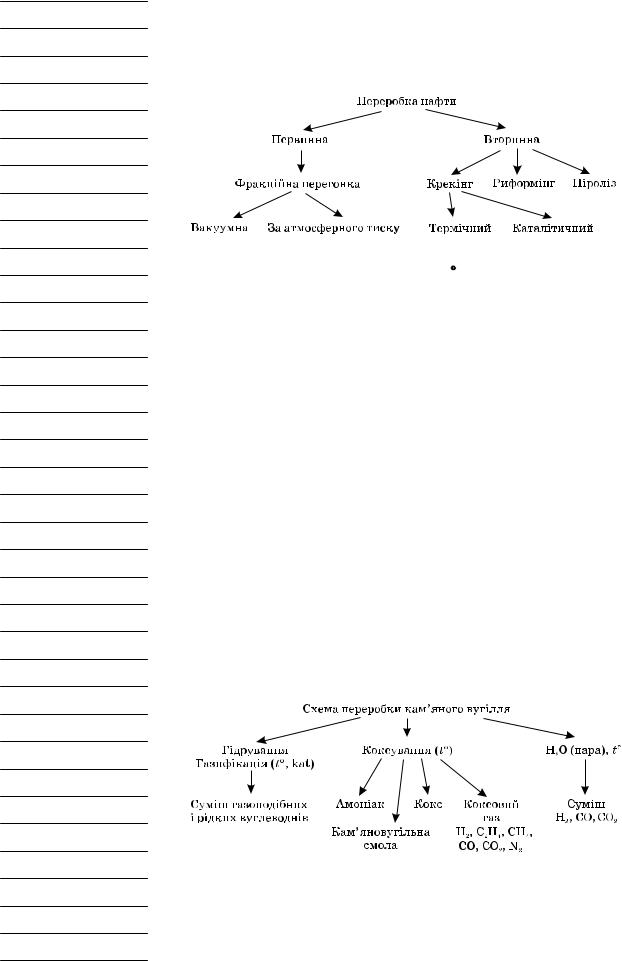
2) Які природні корисні копалини є джерелами органічних сполук? (Розглядаємо колекції «Нафта й продукти її переробки», «Кам’яне вугілля й продукти переробки», схему «Продукти переробки природного газу».)
3) У чому полягає причина різноманіття органічних сполук? (Розглядаємо схему «Класифікації органічних сполук».)
4) Які речовини називаються гомологами? Наведіть приклади гомологічних рядів.
5) Які речовини називаються ізомерами? Які види ізомерії поширені в органічній хімії? Наведіть приклади.
6) Чим відрізняються природні й хімічні органічні речовини? Природні: рослинного й тваринного походження.
Хімічні: штучні (отримані на основі природних) і синтетичні (немає аналогів у природі).
ІІІ. Застосування знань, умінь і навичок
Групова робота
Групи заздалегідь готують відповіді, а на уроці представляють підготовлені схеми, таблиці, презентації.
1. Розгляд схеми переробки природного газу
Склад і використання природних і супутнього нафтових газів
Склад |
Природний газ |
Супутній нафтовий газ |
|
|
|
Метан |
88–98 % |
31–72 % |
|
|
|
Етан |
0,2–4,4 % |
7,5–21 % |
|
|
|
Пропан |
0,07–1,7 % |
5,2–21,5 % |
|
|
|
Бутан |
0–0,8 % |
2,3–20,4 % |
|
|
|
Пентан і вище |
0–0,6 % |
0,3–19,8 % |
|
|
|
Сірководень, азот, |
1,35–16,7 % |
0–10,7 % |
інші речовини |
|
|
|
|
|
Застосування |
Паливо, сировина для |
Газовий бензин (пентан, гексан), пропан- |
|
органічного синтезу |
бутанова суміш, сухий лід (метан) — па- |
|
|
ливо, сировина для органічного синтезу |
|
|
|
115
Розглядаємо схему використання природного газу.
1) Як паливо. (Назвіть галузі промисловості, де природний газ використовується як паливо.)
2) Як сировина хімічних виробництв.
2. Розгляд схеми переробки нафти
Фракція |
Кількість атомів |
Інтервал температур |
Галузі застосування |
Карбону в молекулі |
кипіння, °С |
||
|
|
|
|
Газова |
C1 — C4 |
40 |
Паливо (опалення, газові |
|
|
|
плити) |
Бензин |
C5 — C10 |
40–180 |
Паливо (літаки, автомобілі |
|
|
|
та ін.), розчинники, сирови- |
|
|
|
на для одержання штучних |
|
|
|
вуглеводнів |
|
|
|
|
Лігроїн |
C8 — C14 |
150–250 |
Дизельне паливо, розчинни- |
|
|
|
ки, продукти переробки для |
|
|
|
одержання бензину |
|
|
|
|
Гас |
C11 — C12 |
180–230 |
Паливо для реактивних |
|
|
|
і тракторних двигунів, роз- |
|
|
|
чинники |
|
|
|
|
Легкий |
C13 — C17 |
230–305 |
Паливо для дизельних двигу- |
газойль |
|
|
нів, масла |
Важкий |
C18 — C25 |
305–400 |
|
газойль |
|
|
|
Мазут |
Суміш вищих вугле- |
Понад 350 |
Паливо для парових казанів, |
(залишок |
воднів |
|
сировина для виробництва |
перегон- |
|
|
мастильних матеріалів, пара- |
ки) |
|
|
фін, вазелін, гудрон |
|
|
|
|
3. Схема переробки кам’яного вугілля
Переробка вугілля — суха перегонка — полягає в його хімічному розкладанні без доступу повітря. Розрізняють два види сухої перегонки: напівкоксування (500–550 °С) і коксування — промисловий метод переробки кам’яного вугілля, що полягає в нагріванні його без доступу повітря до 900–1050 °С.
4. Штучні органічні речовини (на прикладі ацетатного волокна, нітроцелюлози)
5. Синтетичні органічні речовини (на прикладі капрону) 6. Полімерні матеріали
ІV. Домашнє завдання
116

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 60
Тема уроку. Значення продуктів органічної хімії Цілі уроку: узагальнити й систематизувати знання учнів про органічні
сполуки;формуватиуявленняучнівпрозначенняорганічної хімії в життєдіяльності людини.
Тип уроку: узагальнення й систематизації знань. Форми роботи: фронтальна, групова, самостійна робота.
Обладнання: картки-завдання.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
1. Заслуховування повідомлень учнів про синтетичні та штучні органічні сполуки, їх застосування і значення
2. Коротке узагальнення вчителя про значення органічної хімії та продуктів органічного синтезу
3. Фронтальне опитування
yy Чому відрізняються фізичні властивості речовин, що належать до одного гомологічного ряду? Наведіть приклади.
yy Які речовини утворюються в результаті гідролізу в організмі людини: а) жири; б) вуглеводи; в) білки? Куди надходять продукти гідролізу й для чого використовуються?
yy Подумайте й обґрунтуйте екологічну доцільність і небезпеку використання синтетичних і штучних органічних речовин.
ІІІ. Виконання тренувальних вправ
1. Групова робота Завдання 1. Напишіть рівняння реакцій за схемою на прикладі конкретної
сполуки:
Алкани → галогенозаміщений алкан → спирт → карбонова кислота → галогенозаміщена карбонова кислота → амінокислота → дипептид
Розглядаємо запропоновані учнями неповторювані схеми, підтверджені рівняннями реакцій.
2. Самостійна робота Завдання 2
yy Запишіть по одній формулі сполук із класу алканів, алкенів і алкінів. yy Запишіть рівняння горіння цих речовин.
yy Обчисліть об’єм повітря, що знадобиться для спалювання цієї суміші. Об’єм і співвідношення компонентів суміші наведено в таблиці.
Варіант |
Об’єм суміші, л |
Співвідношення об’ємів компонентів суміші |
|||
|
|
|
|||
(н. у.) |
алкан |
алкен |
алкін |
||
|
|||||
|
|
|
|
|
|
1 |
20 |
1 |
2 |
2 |
|
|
|
|
|
|
|
2 |
30 |
2 |
2 |
2 |
|
|
|
|
|
|
|
3 |
25 |
2 |
1 |
2 |
|
|
|
|
|
|
|
4 |
50 |
3 |
1 |
1 |
|
|
|
|
|
|
|
5 |
40 |
1 |
2 |
1 |
|
|
|
|
|
|
|
6 |
35 |
3 |
3 |
1 |
|
|
|
|
|
|
|
7 |
28 |
2 |
3 |
2 |
|
|
|
|
|
|
|
8 |
40 |
4 |
1 |
1 |
|
|
|
|
|
|
|
117

Завдання 3. Яку масу спирту можна одержати в результаті переробки відповідного вуглеводу?
Варіант |
Вихідна речовина |
Маса речовини, |
Масова частка виходу |
|
кг |
продукту реакції, % |
|||
|
|
|||
|
|
|
|
|
1 |
Крохмаль |
300 |
72 |
|
|
|
|
|
|
2 |
Сахароза |
12 |
80 |
|
|
|
|
|
|
3 |
Глюкоза |
280 |
95 |
|
|
|
|
|
|
4 |
Целюлоза |
200 |
64 |
|
|
|
|
|
|
5 |
Крохмаль |
180 |
68 |
|
|
|
|
|
|
6 |
Целюлоза |
240 |
56 |
|
|
|
|
|
|
7 |
Глюкоза |
340 |
96 |
|
|
|
|
|
|
8 |
Сахароза |
520 |
90 |
|
|
|
|
|
Завдання 4. Використовуючи таблицю амінокислот, запишіть формулу трипептиду, утвореного нижченаведеними амінокислотами. Обчисліть молекулярну масу трипептиду.
Варіант |
Амінокислота 1 |
Амінокислота 2 |
Амінокислота 3 |
Молярна маса |
|
трипептиду |
|||||
|
|
|
|
||
|
|
|
|
|
|
1 |
Гліцин |
Серин |
Аланін |
|
|
|
|
|
|
|
|
2 |
Цистеїн |
Аланін |
Цистеїн |
|
|
|
|
|
|
|
|
3 |
Аланін |
Аланін |
Глутамін |
|
|
|
|
|
|
|
|
4 |
Лізин |
Гліцин |
Гліцин |
|
|
|
|
|
|
|
|
5 |
Гліцин |
Аланін |
Аланін |
|
|
|
|
|
|
|
|
6 |
Серин |
Гліцин |
Гліцин |
|
|
|
|
|
|
|
|
7 |
Глутамін |
Аланін |
Гліцин |
|
|
|
|
|
|
|
|
8 |
Серин |
Цистеїн |
Аланін |
|
|
|
|
|
|
|
Завдання 5. Обчисліть масу кожної амінокислоти, що утвориться в результаті повного гідролізу 100 г такого трипептиду.
IV. Підбиття підсумків уроку
Учитель оцінює роботу учнів на уроці.
V. Домашнє завдання
Повторити вивчений матеріал, підготуватися до тематичного оцінювання.
118

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 61
Тема уроку. Контроль знань з теми «Органічні сполуки» Цілі уроку: узагальнити й скоригувати знання учнів з теми «Органічні
сполуки»; з’ясувати рівень навчальних досягнень учнів зтеми,розумінняосновнихпонять,уміннявикористовувати їх на практиці.
Тип уроку: контролю й коригування знань, умінь і навичок. Форма роботи: письмова самостійна робота за варіантами.
Обладнання: картки-завдання.
Хід уроку
І. Організація класу
ІІ. Письмова контрольна робота
Учитель розподіляє варіанти й нагадує учням зміст завдань, час виконання, ключові моменти оформлення відповідей і систему оцінювання:
yy завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, у сумі перші шість завдань дають 3 бали;
yy завдання 7–9 оцінюються по 2 бали, разом за дев’ять правильно виконаних завдань — 9 балів;
yy завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Таким чином, максимальна оцінка за правильно виконану роботу становить 12 балів.
Час на виконання роботи — 40 хв.
ІІІ. Домашнє завдання
Підготувати повідомлення про значення хімії в життєдіяльності людини.
Варіант І
1.Денатурація білків — це реакція руйнування структури: а) первинної; б) вторинної;
в) вторинної та третинної.
2. Укажіть серед наведених сполук естер:
а) C2H5 −OH;
б) CH3 −CH2 −CH −COOH;
в) CH3 −COOC2H5; |
|
|||
г) (C H |
|
O |
) . |
|
6 10 |
5 |
n |
|
|
3. Вторинна структура білка зумовлена... |
||||
4. Установіть відповідність. |
|
|||
1. CH3 |
−CH2 −CH2 −CH2 −OH |
А. 1-бутанол |
||
2. CH3 |
−COOC4H9 |
Б. α-амінобутанова кислота |
||
3. CH3 |
−CH2 −CH(NH2 ) −COOH |
В. Бутиловий естер оцтової кислоти |
||
5. Амінокислоти — це речовини, у молекулах яких одночасно містяться функціональні групи:
а) аміно- й гідроксильна; б) карбоксильна й гідроксильна; в) аміно- й карбоксильна.
6. Нуклеїнові кислоти — це: а) природні полімери; б) штучні полімери;
в) мономери для синтезу білка.
7. Напишіть рівняння утворення трипептиду з двох молекул гліцину й молекули серину.
119

8. Обчисліть масу амінооцтової кислоти, яку можна одержати з хлороцтової кислоти масою 48 г і амоніаку.
9. Запишіть рівняння реакцій за схемою:
Бутанол → бутанова кислота → 2-хлорбутанова кислота → 2-амінобутанова кислота
10.Обчисліть масу тринітроцелюлози, яку можна одержати із целюлози масою 32 г, якщо масова частка виходу продукту становить 97 %.
Варіант ІІ
1. Вторинна структура білка підтримується наявністю в молекулі білка зв’язків:
а) пептидних; б) водневих; в) дисульфідних.
2. Укажіть серед наведених сполук 2-амінокислоту:
а) CH3 −CH(NH2 )−COOH;
б) CH3 −CH2 −CH(OH) −COOH;
в) CH3 −CH2 −CH2 −COOH;
г) CH3 −CH(NH2 )−CH2 −COOH.
3. Первинна структура білка зумовлена...
4. Установіть відповідність.
1. CH3 |
−CH2 −CH2 −CH2 −CH2 −OH |
А. Амінооцтова кислота |
2. CH3 |
−COOC5H11 |
Б. 2-пентанол |
3. CH2 |
(NH2 )−COOH |
В. Пентиловий естер оцтової кислоти |
5. Денатурація білка відбувається під дією: а) води; б) кислот; в) радіації.
6. Нуклеотид складається із залишків: а) вуглеводню, ортофосфатної кислоти;
б) нітрогеновмісної основи, вуглеводню, ортофосфатної кислоти; в) нітрогеновмісної основи, вуглеводню, сульфатної кислоти.
7. Напишіть рівняння утворення трипептиду з молекули аланіну і двох молекул гліцину.
8. Обчисліть масу 2-амінопропанової кислоти, яку можна одержати з 20 г 2-хлорпропанової кислоти й амоніаку.
9. Запишіть рівняння реакцій за схемою:
Етанол → етанова кислота → хлоретанова кислота → аміноетанова кислота
10.Обчисліть масу капронового волокна, яке можна одержати в результаті поліконденсації 6-аміногексанової кислоти масою 48,4 г, якщо вихід продукту реакції становить 94 %.
120
