
Билеты
.docx
1.
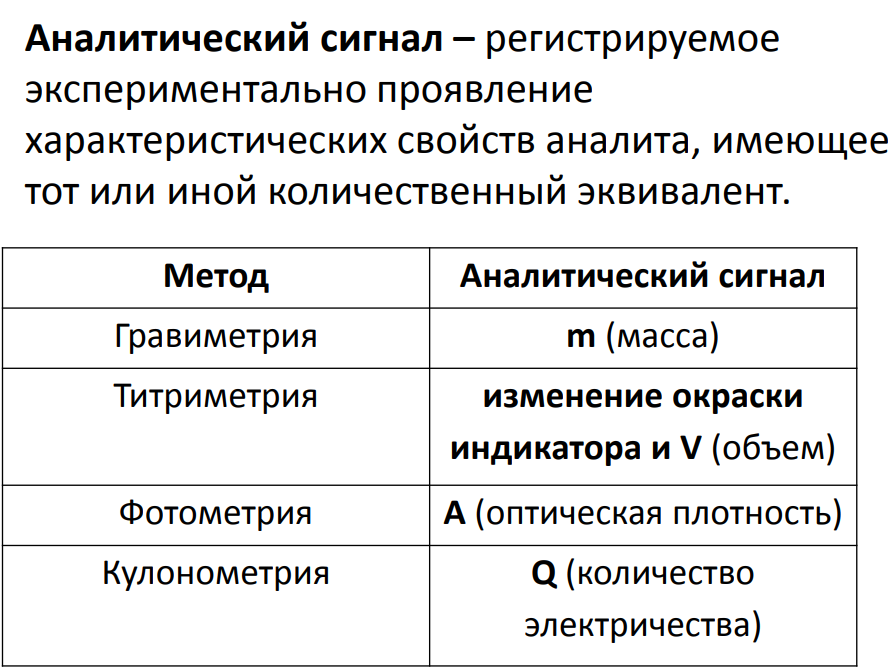
Аналитическая химия и химический анализ.
Предмет и задачи аналитической химии.
Качественный, количественный и структурный
анализ. Аналитический сигнал как источник
информации о качественном и количественном
составе вещества. Классификация методов
химического анализа по сложности
(элементный, молекулярный, функциональный,
фазовый), по количеству анализируемого
вещества (макро-, полумикро-, микро- и
ультрамикрометоды) и по характеру
аналитического сигнала.
2.
Количественный химический анализ, его
задачи и методы. Классификация методов
количественного анализа. Определение
основных и сопутствующих компонентов.
Основные этапы количественного анализа.
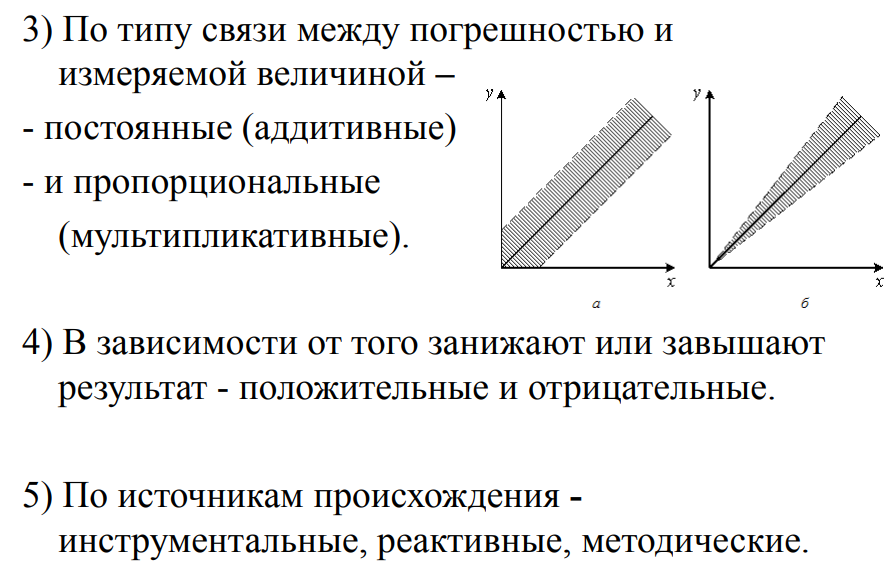
3. Метрологические характеристики
анализа (правильность, воспроизводимость,
сходимость, точность). Погрешности
анализа, их источники и классификация
– систематические, случайные, промахи.
Способы обнаружения и учета погрешностей.
Абсолютные и относительные погрешности
результата анализа, примеры
4.
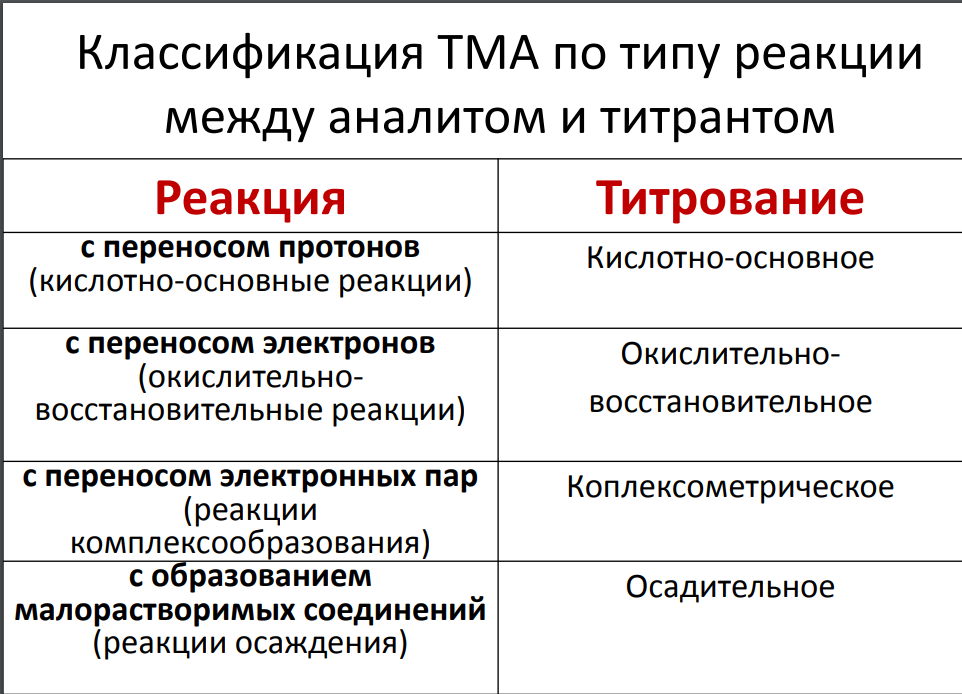
Титриметрический (объемный) метод
анализа. Сущность. Требования к реакциям,
лежащим в его основе. Классификация по
типу реакций, протекающих между
определяемым веществом и титрантом.
Основные приемы титрования – прямое,
по остатку, замещение. Примеры.
5.
Приготовление рабочих растворов с
приготовленным и установленным титром.
Требования к установочным (стандартным)
веществам. Методы отдельных навесок и
аликвотных частей (пипетирования).
Поправочный коэффициент к концентрации
(К). Фиксаналы (титрстандарты). Примеры.
Способы выражения концентрации вещества
в растворе и их взаимосвязь. Расчет
количества вещества с использованием
различных способов выражения концентраций.
6. Кислотно-основное титрование.
Рабочие растворы и способы их приготовления.
Определение точной концентрации кислот
и щелочей. Стандартные вещества и
растворы, применяемые в методе
кислотно-основного титрования.
7.
Кислотно-основные индикаторы, механизм
их действия. Интервал перехода окраски
и показатель титрования кислотно-основных
индикаторов, его связь с константой
диссоциации индикатора. Выбора
кислотно-основного индикатора.
Индикаторные погрешности – водородная,
гидроксильная, кислотная, основная.
Оценка индикаторной погрешности.
Примеры.
8. Расчет, построение
и анализ кривых титрования сильных и
слабых одноосновных кислот сильными
основаниями (щелочами). Выбор индикатора.
Примеры.
9. Расчет, построение
и анализ кривых титрования сильных и
слабых однокислотных оснований сильными
кислотами. Выбор индикатора. Примеры.
10. Титрование многоосновных
кислот (H2CO3, H3PO4) и смеси кислот. Условия
дифференцированного определения. Вид
кривых титрования, выбор индикаторов.
Примеры.
11. Титрование
солей одно- и многоосновных слабых
кислот. Расчет и построение кривых
титрования, выбор индикаторов. Примеры.
12. Анализ карбонатных (Na2CO3
+ NaOH, Na2CO3 + NaHCO3) смесей. Титрант, индикаторы,
расчетные формулы, кривые титрования.
13. Количественное определение
солей аммония и азота в органических
соединениях по методу Кьельдаля –
методы титрования по остатку и замещения.
Титранты, индикаторы, расчетные формулы.
14. Кислотно-основное
титрование в неводных растворителях,
достоинства и недостатки. Характеристика
неводных растворителей, их дифференцирующее
и нивелирующее действие. Рабочие растворы
и индикаторы при титровании в неводной
среде. Примеры определений.
15.
Окислительно-восстановительное
титрование; требования к реакциям,
лежащим в его основе. Классификация
методов окислительно-восстановительного
титрования по типу титранта. Определение
конечной точки титрования – специфические
и редоксиндикаторы, принципы их действия.
Примеры.
16. Расчет, построение и
анализ кривых окислительно-восстановительного
титрования. Выбор индикатора. Важнейшие
окислительно-восстановительные (редокс)
индикаторы, механизм их действия.
Интервал перехода окраски редоксиндикаторов
и его связь со стандартным
окислительно-восстановительным
потенциалом.
17. Перманганатометрия.
Общая характеристика метода, его
достоинства и недостатки. Рабочий
раствор, его приготовление, стандартизация
и хранение. Условия титрования и
фиксирование конечной точки титрования.
Примеры количественных определений.
Расчетные формулы.
18.
Иодометрия. Общая характеристика метода.
Рабочие растворы, приготовление,
стандартизация и хранение. Условия
титрования - кислотность среды,
температура, индикаторы. Примеры
косвенного иодометрического определения
сильных кислот, воды (метод Фишера).
Расчетные формулы.
19.
Иодометрия (иодометрия, иодиметрия,
иодатометрия). Общая характеристика
методов. Определение окислителей и
восстановителей, органических соединений.
Рабочие растворы, приготовление,
стандартизация и хранение. Условия
титрования - кислотность среды,
температура, индикаторы. Прямое, обратное,
заместительное титрование. Расчетные
формулы. Примеры.
20.
Броматометрия. Общая характеристика
метода, его достоинства и недостатки.
Рабочий раствор, его приготовление,
стандартизация и хранение. Фиксирование
конечной точки титрования. Условия и
примеры количественного определения
неорганических и органических соединений.
Расчетные формулы.
21.
Нитритометрия. Общая характеристика
метода, его достоинства и недостатки.
Рабочий раствор, его приготовление,
стандартизация и хранение. Фиксирование
конечной точки титрования. Условия и
примеры количественного определения
неорганических и органических соединений.
Расчетные формулы.
22.
Цериметрия и дихроматометрия. Общие
характеристики методов, их достоинства
и недостатки. Рабочие растворы,
приготовление, стандартизация и хранение.
Фиксирование конечной точки титрования.
Условия и примеры количественных
определений неорганических и органических
соединений. Расчетные формулы.
23.
Комплексиметрическое титрование.
Меркуриметрия. Общая характеристика
метода, его достоинства и недостатки.
Рабочий раствор, его приготовление,
стандартизация и хранение. Фиксирование
конечной точки титрования. Условия и
примеры количественного определения
соединений. Расчетные формулы.
24.
Методы предварительного восстановления
и окисления в окислительно-восстановительном
титровании. Определение трех- и
двухвалентного железа раздельно и при
совместном присутствии в водном растворе.
Рабочие растворы, определение конечной
точки титрования, расчетные формулы.
25. Комплексонометрия.
Важнейшие комплексоны, применяемые в
химическом анализе – аминотриуксусная
кислота, ЭДТА. Состав и свойства
комплексонатов металлов. Влияние
кислотности на образование и условные
константы устойчивости комплексонатов.
Приготовление и стандартизация рабочего
раствора трилона Б. Методы
комплексонометрического титрования -
прямое, по остатку, замещения. Расчетные
формулы, примеры определений.
26.
Расчет, построение и анализ кривых
комплексонометрического титрования
на примере определения Са2+ трилоном Б
при рН=10. Выбор индикатора. Важнейшие
металлхромные индикаторы (эриохром
черный Т, ПАН, ПАР, мурексид и др.) и
механизм их действия. Интервал перехода
окраски и показатель титрования
металлхромных индикаторов.
27.
Определение общей, временной и постоянной
жесткости воды методами кислотноосновного
и комплексонометрического титрования.
Титранты, индикаторы, расчетные формулы.
28. Осадительное титрование.
Требования к реакциям, лежащим в его
основе. Классификация методов осадительного
титрования. Расчет, построение и анализ
кривых осадительного титрования.
Определение конечной точки. Примеры.
29. Аргентометрия. Метод
Мора. Общая характеристика метода, его
достоинства и недостатки. Рабочий
раствор, его приготовление, стандартизация
и хранение. Фиксирование конечной точки
титрования. Условия и примеры
количественного определения неорганических
и органических соединений. Расчетные
формулы.
30. Аргентометрия.
Метод Фольгарда. Общая характеристика
метода, его достоинства и недостатки.
Рабочие растворы, приготовление,
стандартизация и хранение. Фиксирование
конечной точки титрования. Условия и
примеры количественного определения
соединений. Расчетные формулы.
31.
Аргентометрия. Метод Фаянса. Общая
характеристика метода, его достоинства
и недостатки. Рабочий раствор, его
приготовление, стандартизация и хранение.
Фиксирование конечной точки титрования.
Важнейшие адсорбционные индикаторы,
их свойства и примеры применения. Примеры
количественных определений. Расчетные
формулы.
32. Меркурометрия,
бариметрия и сульфатометрия. Общие
характеристики методов, их достоинства
и недостатки. Рабочие растворы,
приготовление, стандартизация и хранение.
Фиксирование конечной точки титрования.
Условия и примеры количественных
определений. Расчетные формулы.
33.
Гравиметрический (весовой) анализ.
Возможности гравиметрии и область её
применения. Методы выделения, отгонки
и осаждения, их сущность и основные
этапы. Примеры применения в анализе.
Расчет результатов анализа, гравиметрический
(аналитический) фактор пересчета.
34. Гравиметрия. Форма
осаждения в гравиметрии и требования,
предъявляемые к ней. Основы теории
образования кристаллических и аморфных
осадков. Влияние процессов соосаждения
(адсорбция, окклюзия, инклюзия) на
результаты весового анализа и способы
его уменьшения. Выбор осадителя при
гравиметрическом определении и расчет
его количества. Важнейшие неорганические
и органические реагенты-осадители.
Осаждение по методу возникающих
реагентов.
35. Гравиметрия.
Промывание кристаллических и аморфных
осадков. Выбор промывной жидкости и
расчет потерь при промывании за счет
растворимости. Фильтрование. Весовая
форма и требования, предъявляемые к
ней. Способы перевода формы осаждения
в весовую форму – высушивание и
прокаливание. Гигроскопичность осадков,
понятие о воздушносухом и абсолютно-сухом
веществе. Пересчет результатов анализа
влажных образцов на абсолютно-сухое
вещество.
1.


 Задача
качественного анализа – обнаружение
отдельных компонентов (элементов, ионов,
соединений) анализируемого образца и
идентификация соединений. Задача
количественного анализа – определение
количеств (концентрации или массы
компонентов).
Задача
качественного анализа – обнаружение
отдельных компонентов (элементов, ионов,
соединений) анализируемого образца и
идентификация соединений. Задача
количественного анализа – определение
количеств (концентрации или массы
компонентов).


 химические
методы основаны на использовании
химических реакций (нейтрализации,
окисления-восстановления, комплексообразования
и осаждения), в которые вступает
анализируемое вещество.
физические
методы не используют химические реакции,
а измеряют какие-либо физические свойства
(оптические, электрические, магнитные,
тепловые и др.) анализируемого вещества,
которые являются функцией его
состава.
физико-химические методы
используют изменение физических свойств
анализируемой системы в результате
протекания химических реакций.
химические
методы основаны на использовании
химических реакций (нейтрализации,
окисления-восстановления, комплексообразования
и осаждения), в которые вступает
анализируемое вещество.
физические
методы не используют химические реакции,
а измеряют какие-либо физические свойства
(оптические, электрические, магнитные,
тепловые и др.) анализируемого вещества,
которые являются функцией его
состава.
физико-химические методы
используют изменение физических свойств
анализируемой системы в результате
протекания химических реакций.
 элементный
анализ– это установление наличия и
количественного содержания химических
элементов в веществе, то есть нахождение
его элементного состава;
элементный
анализ– это установление наличия и
количественного содержания химических
элементов в веществе, то есть нахождение
его элементного состава;
функциональный анализ– это установление наличия и количественного содержания функциональных групп в молекулах органических соединений;
молекулярный анализ– это установление наличия и количественного содержания молекул индивидуальных химических соединений в веществе, смесях и материалах;
фазовый анализ– это анализ вещества на наличие в нем отдельных фаз, различающихся по своим химическим и физическим свойствам и отделенных друг от друга поверхностями раздела.
В
зависимости от того, с каким количеством
вещества оперируют при выполнении
анализа различают макро-, полумикро-,
микро- и ультрамикроанализ. При макро-
и полумикрометоде используют обычную
химическую посуду, система работы в
обоих методах идентична, однако
преимуществом полумикроанализа является
значительно меньший расход реактивов.
Микро- и ультрамикроанализ требует
использования высокочувствительных
реакций, специальных методов и аппаратуры.
На практике в обычных химических
лабораториях чаще всего применяется
полумикроанализ.
 2.
2.
 Количественный
химический анализ – это определение
количественного состава, т.е. установление
количества химических элементов, ионов,
атомов, атомных групп, молекул в
анализируемом веществе.
Основной
задачей количественного анализа является
определение количества отдельных
химических компонентов входящих в
состав анализируемого вещества
Количественный
анализ делятся на
1)Химический
а)
Весовой (гравиметрия)
б) Объёмный
(титраметрия)
2) Физико-химический
(фотометрия, хроматометрия)
3) Физические
(сложные спектральные
методы)
3.
Количественный
химический анализ – это определение
количественного состава, т.е. установление
количества химических элементов, ионов,
атомов, атомных групп, молекул в
анализируемом веществе.
Основной
задачей количественного анализа является
определение количества отдельных
химических компонентов входящих в
состав анализируемого вещества
Количественный
анализ делятся на
1)Химический
а)
Весовой (гравиметрия)
б) Объёмный
(титраметрия)
2) Физико-химический
(фотометрия, хроматометрия)
3) Физические
(сложные спектральные
методы)
3.





 Источники
погрешностей
Влияние окружающей
среды
Порог чувствительности
прибора
Субъективная погрешность
оператора
Источники
погрешностей
Влияние окружающей
среды
Порог чувствительности
прибора
Субъективная погрешность
оператора




 4.
4.








 5.
5.

 Первичный
стандарт готовят путем растворения
точной навески вещества в определенном
объёме растворителя
Вторичный
стандарт готовят сначала с приблизительной
концентрацией близкой к требуемой по
приблизительной навеске, а затем
определяют точную концентрацию с помощью
первичного стандарта
Первичный
стандарт готовят путем растворения
точной навески вещества в определенном
объёме растворителя
Вторичный
стандарт готовят сначала с приблизительной
концентрацией близкой к требуемой по
приблизительной навеске, а затем
определяют точную концентрацию с помощью
первичного стандарта




 Фиксаналы
содержат точно фиксированное количество
вещества обычно 0.1 моль эквивалента.
Это стеклянные ампулы, содержащие точно
отвешенные количества различных твердых
веществ или точно отмеренные объемы
растворов, необходимые для приготовления
1 л раствора точной концентрации. Для
приготовления раствора из стандарт-титра
содержимое ампулы количественно
переносят в мерную колбу на 1 л, после
чего растворяют вещество и доводят
объем до метки
Примеры:KMnO4
K2Cr2O7
NaCl
H2C2O4
HCl
AgNO3
Требования:
Чистые устойчивые при комнатной
температуре
Не должны адсорбировать
H2O
и CO2
из воздуха
Фиксаналы
содержат точно фиксированное количество
вещества обычно 0.1 моль эквивалента.
Это стеклянные ампулы, содержащие точно
отвешенные количества различных твердых
веществ или точно отмеренные объемы
растворов, необходимые для приготовления
1 л раствора точной концентрации. Для
приготовления раствора из стандарт-титра
содержимое ампулы количественно
переносят в мерную колбу на 1 л, после
чего растворяют вещество и доводят
объем до метки
Примеры:KMnO4
K2Cr2O7
NaCl
H2C2O4
HCl
AgNO3
Требования:
Чистые устойчивые при комнатной
температуре
Не должны адсорбировать
H2O
и CO2
из воздуха




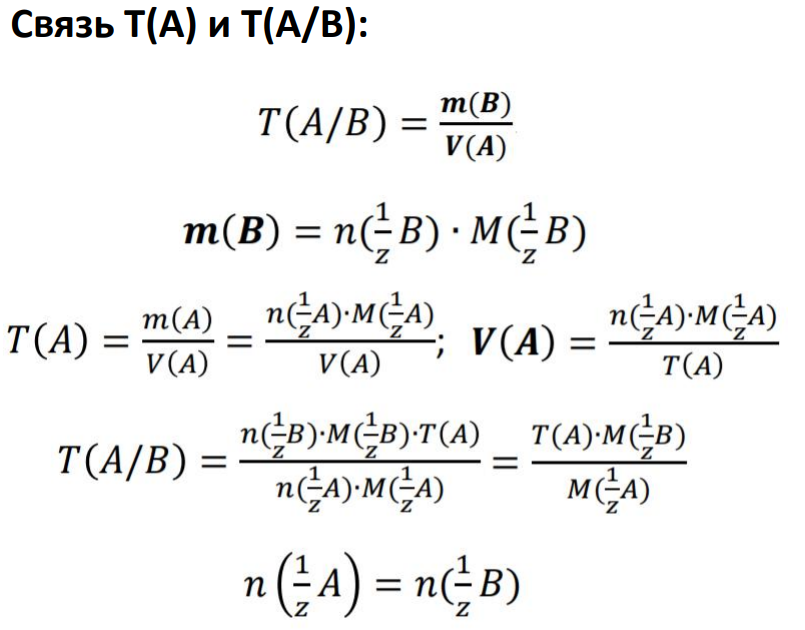

 6.
6.

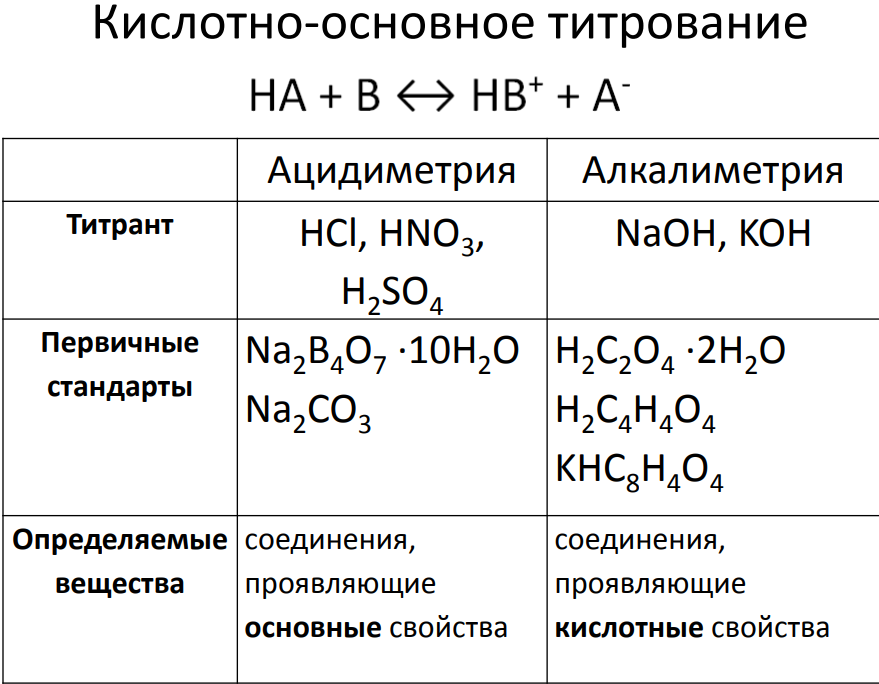 В
ацидиметрии
в качестве рабочего раствора (титранта)
чаще всего используют соляную кислоту,
реже - серную, т.к. она в ряде случаев
может образовывать с исследуемым
веществом осадки, которые будут влиять
на точность результатов анализа. Азотная
кислота, являясь сильным окислителем,
может вступать в побочные реакции, не
предусмотренные стехиометрией основного
процесса, поэтому в ацидиметрии
используется редко, кроме того, её
растворы могут частично разлагаться
при нагревании и на свету.
Растворы
НСl и H2SO4 нельзя приготовить по точной
навеске исходного вещества из-за
летучести первого и гигроскопичности
второго. Поэтому их готовят разбавлением
концентрированных растворов, а затем
точный титр устанавливают с помощью
другого стандартного раствора этих
целей используют растворы карбоната
натрия Na2CO3 (соды) или декагидрата
тетрабората натрия Na2B4O7 ·10H2O (буры),
полученные растворением в соответствующем
объёме H2O рассчитанной навески. Уравнения
протекающих при этом реакций будут
иметь вид: Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2B4O7 +
2HCl + 5H2O = 2NaCl + 4H3BO3
В
ацидиметрии
в качестве рабочего раствора (титранта)
чаще всего используют соляную кислоту,
реже - серную, т.к. она в ряде случаев
может образовывать с исследуемым
веществом осадки, которые будут влиять
на точность результатов анализа. Азотная
кислота, являясь сильным окислителем,
может вступать в побочные реакции, не
предусмотренные стехиометрией основного
процесса, поэтому в ацидиметрии
используется редко, кроме того, её
растворы могут частично разлагаться
при нагревании и на свету.
Растворы
НСl и H2SO4 нельзя приготовить по точной
навеске исходного вещества из-за
летучести первого и гигроскопичности
второго. Поэтому их готовят разбавлением
концентрированных растворов, а затем
точный титр устанавливают с помощью
другого стандартного раствора этих
целей используют растворы карбоната
натрия Na2CO3 (соды) или декагидрата
тетрабората натрия Na2B4O7 ·10H2O (буры),
полученные растворением в соответствующем
объёме H2O рассчитанной навески. Уравнения
протекающих при этом реакций будут
иметь вид: Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2B4O7 +
2HCl + 5H2O = 2NaCl + 4H3BO3 В
алкалиметрии
в качестве титрантов используют растворы
щелочей (NaOH, KOH, Ba(OH)2 ). Их не готовят по
точной массе рассчитанной навески,
поскольку щелочи являются гигроскопичными
и даже при правильном хранении содержат
в качестве примесей небольшое количество
воды и карбонатов, а получают разбавлением
концентрированных растворов с последующей
стандартизацией другим раствором, титр
которого известен. Для этих целей обычно
используют стандартные растворы
щавелевой Н2С2О4 или янтарной Н2С4Н4О4
кислот: Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O Н2С4Н4О4 + 2NaOH
= Na2C4H4O4 + 2H2O
В
алкалиметрии
в качестве титрантов используют растворы
щелочей (NaOH, KOH, Ba(OH)2 ). Их не готовят по
точной массе рассчитанной навески,
поскольку щелочи являются гигроскопичными
и даже при правильном хранении содержат
в качестве примесей небольшое количество
воды и карбонатов, а получают разбавлением
концентрированных растворов с последующей
стандартизацией другим раствором, титр
которого известен. Для этих целей обычно
используют стандартные растворы
щавелевой Н2С2О4 или янтарной Н2С4Н4О4
кислот: Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O Н2С4Н4О4 + 2NaOH
= Na2C4H4O4 + 2H2O
 7.
7.





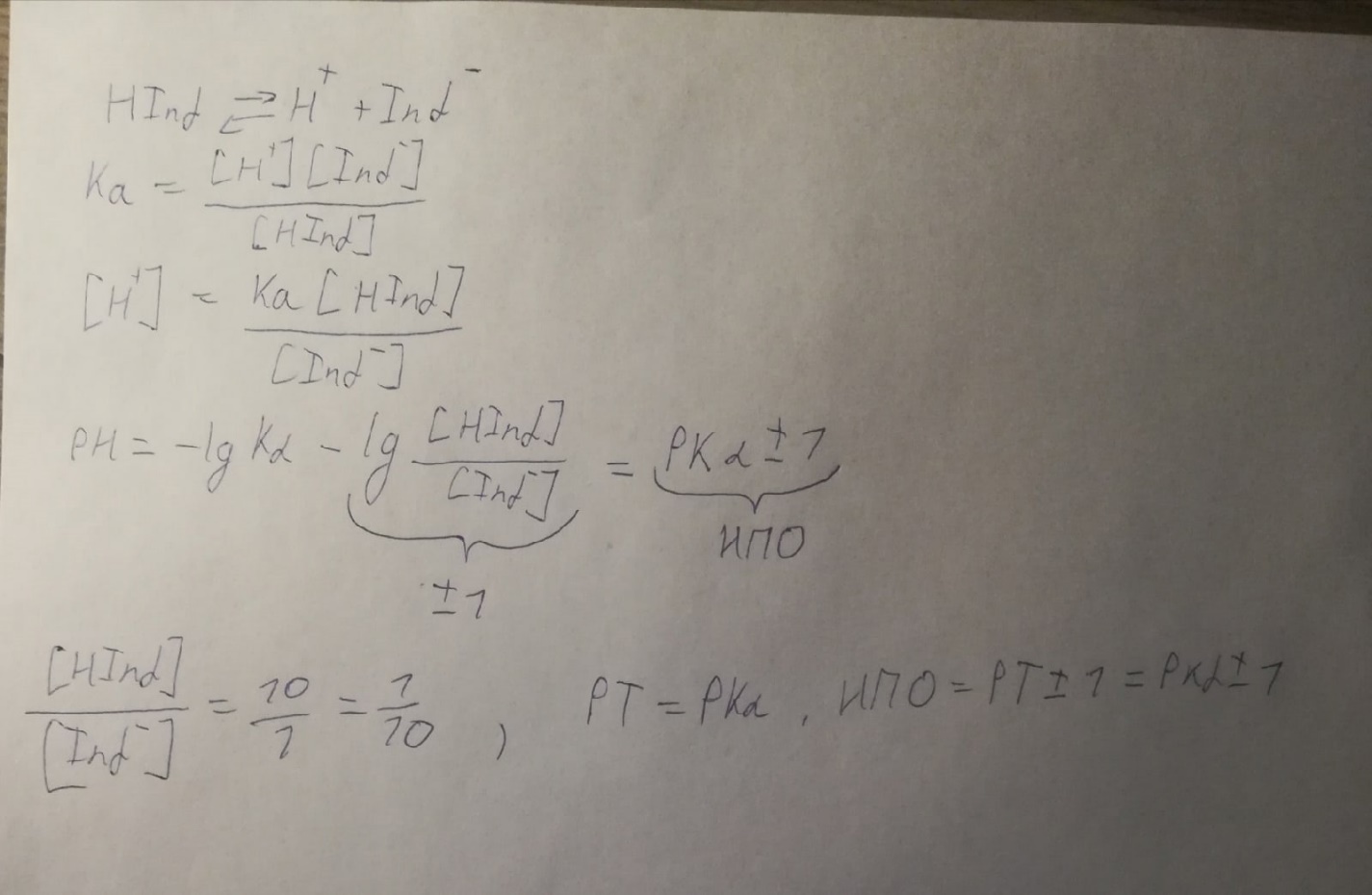 (Кислотная
форма)Hind
↔H+
+ (основная форма)Ind-
У двухцветного окрашены 2 формы
кислотная и основная
У одноцветного
1 форма, кислая
(Кислотная
форма)Hind
↔H+
+ (основная форма)Ind-
У двухцветного окрашены 2 формы
кислотная и основная
У одноцветного
1 форма, кислая





 8.
8.






 9.
9.





 10.
10.






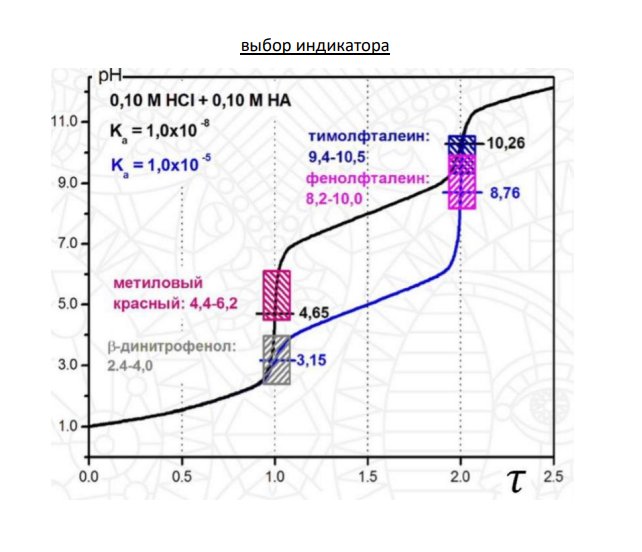 11.
11.







12.




13.






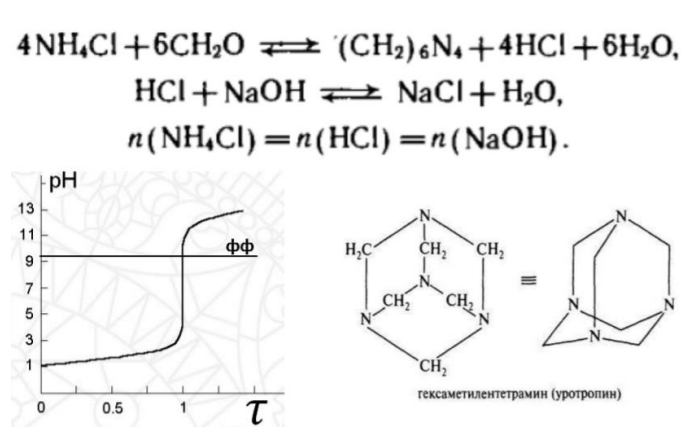 14.
14.







15.






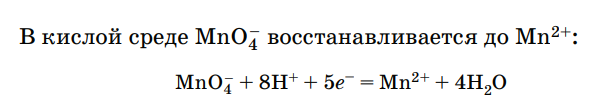











![]()












