
zadat-fkh
.pdf2.12 Найти ∆S при смешении 100 м3 Н2 при Т = 303 К и 200 м3 Н2
при Т = 293 К. Давление газов до смешения Р1 = Р2 = Робщ = 1,1·105 Н/м2. Считать газ идеальным. Ср = 29,309 Дж/(моль·К).
2.13 Найти изменение энтропии при охлаждении 25 кг брома от 373 до 173 К при постоянном давлении, если :
Тпл = 265,9 К; |
Сртв = 0,674 |
Дж/(г·К); |
|
Ткип = 332,2 К; |
Срж |
= 0,461 |
Дж/(г·К); |
∆Нпл = 10,55 кДж/моль; |
Срг |
= 0,225 |
Дж/(г·К); |
∆Нисп = 30,7 кДж/моль.
2.14Вычислить изменение энтропии при нагревании 16 кг кислорода от 273 до 373 К : а) при постоянном объеме, б) при постоянном давлении. Считать О2 идеальным газом.
2.15Определить энтропию 1·10-3 м3 метана при 800 К и Р = 1 атм. Стандартная энтропия метана при 298 К равна 167,73 Дж/(моль·К).
2.16Под давлением 19,6·104 Па нагревают 2·10-3 м3 Аr до тех пор, пока объем его не увеличится до 12·10-3 м3. Каково изменение энтропии, если начальная температура 373 К?
2.17Бромбензол кипит при 429,8 К, его теплота парообразования при этой
температуре 241,9 Дж/г. Рассчитать изменение энтропии при испарении 10 кг бромбензола.
2.18 Под давлением 2,0·105 Н/м2 нагревают 4·10-3 м3 аргона до тех пор, пока объем его не увеличится до 12·10-3 м3. Каково изменение энтропии, если начальная температура 323 К?
2.19 Рассчитать общее возрастание энтропии при смешении 100·10-6 м3 О2 |
с |
|||
400·10-6 м3 N2 при 280 К и Р=1,01·105 Па, V = const. |
|
|||
2.20 Определить |
энтропию 1·10-3 |
м3 водорода при 400 К |
и |
|
Р = 1,01·105 Н/м2, |
если Sо298 = 130,6 Дж/(моль·К), а зависимость молярной |
|||
теплоемкости от температуры выражается уравнением |
|
|||
Ср = 27,28 + 3,26.10-3 Т + |
0,502 Дж/(моль·К). |
|
||
2.21 Определить ∆S при нагревании 2 кг воды от 273,2 до 400 К, если |
|
|||
Тпл = 273,2 К; |
|
Ствр = 1,570 Дж/(г·К); |
|
|
Тн.т.к. = 373,2 К; |
|
Сжр = 4,187 |
Дж/(г·К); |
|
∆Нпл = 6,138 кДж/моль; |
Сгазр = 1,919 Дж/(г·К). |
|
||
21
2.22 Под давлением 1,38·105 Па нагревают 3·10-3 м3 Ne до тех пор, пока объем его не увеличится до 15·10-3 м3. Каково изменение энтропии, если начальная температура 373 К?
3.1 Вычислить ∆G, |
Задача 3 |
|
|
|||
∆U, ∆Н, если 2 кг |
|
|
||||
НСООН |
→ |
|
НСООН |
|||
(тв., 281,5 К, 1 атм) |
(газ, 400 К, 1 атм) |
|||||
Тпл. |
= 281,5 К; |
|
Ср |
ж = 2,135 Дж/ (г·К); |
||
Ткип = 373,7 К; |
|
Ср |
газ =1,058 Дж/ (г·К); |
|||
∆Нпл = 12,687 кДж/моль; |
∆Нисп.= 23,112 кДж/моль. |
|||||
3.2 Вычислить ∆ G, |
∆Н, ∆F для перехода 1 моль нафталина |
|||||
|
С10Н8 |
→ |
|
С10Н8 |
||
(тв., 353,5 К, 1 атм ) |
|
( газ, 520 К, 2 атм) |
||||
Тплав. = 353,5 К; |
|
|
Срж |
= 2,094 Дж/(г·К); |
||
Ткип |
= 491,2 К; |
|
|
Ср газ = 1,023 Дж/(г·К); |
||
∆Нплав. = 19,3 кДж/моль; |
|
∆Нисп. = 43,5 кДж/моль. |
||||
3.3 Вычислить ∆G, ∆F, ∆Н в процессе перехода 1 моль |
||||||
(С2Н5)2 О |
→ |
|
(С2Н5)2О |
|||
(тв., 156,9 К, 1 атм) |
|
|
(газ, 350 К, 1 атм) |
|||
Тпл |
= 156,9 К; |
|
|
Ср |
ж = 2,215 Дж/(г·К); |
|
Ткип |
= 307,2 К; |
|
|
Ср |
газ = 1,934 Дж/(г·К); |
|
∆Нпл = 7,537 кДж/моль; |
|
∆Нисп =26,713 кДж/моль. |
||||
3.4 Вычислить ∆H, ∆G, ∆ F |
для перехода 1 кг |
|||||
|
С6Н5С2Н5 → |
С6Н5С2Н5 |
||||
(тв., 286,5 К, 1 атм) |
|
(газ, 450 К, 1 атм) |
||||
Тпл |
= 286,5 К; |
|
|
Срж |
= 1,964 Дж/(г·К); |
|
Ткип = 411,4 К; |
|
|
Сргаз = 1,891 Дж/(г·К); |
|||
∆Нпл.= 17,125 кДж/моль; |
|
∆Нисп= 6,691кДж/моль. |
||||
3.5Определить изменение ∆F, ∆G, ∆H, ∆U при обратимом испарении 1 моль
брома при давлении 1,013·105 Н/м2, Ткип = 332,2 К и последующем нагревании до 374,7 К, если ∆Нисп = 20,733 кДж/моль, Сргаз = 0,225 Дж/(г·К).
3.6Вычислить ∆Н, ∆U, ∆G для перехода 1 кг
С8Н10 |
→ |
С8Н10 |
|
(тв., 277,9 К, 1 атм) |
(газ, 450 К, 2 атм) |
||
Тпл = 277,9 К; |
Сжр |
= 1,717 Дж/(г·К); |
|
Ткип = 419,2 К; |
Сгазр = 1,296 Дж/(г·К); |
||
∆Нпл = 11,282 кДж/моль; |
∆Нисп = 36,720 кДж/моль. |
||
22
3.7 Вычислить ∆G, ∆F, ∆H перехода 1 моль
н - С5Н12 → |
н - С5Н12 |
атм) |
(тв., 143,5 К, 1 атм) |
(газ, 330 К, 2 |
|
Тпл = 143,5 К; |
Сжр = 2,261 Дж/(г·К); |
|
Ткип = 309,3 К; |
Сгазр = 1,667 |
Дж/(г·К); |
∆Нпл = 8,421 кДж/моль; |
∆Нисп = 25,813 кДж/моль. |
|
3.8 Вычислить ∆G, ∆F, ∆H в процессе перехода 1 моль СНСl3
СНСl3 |
→ CHCl3 |
|||
(тв., 209,7 К, 1 атм) |
|
(газ, 350 К, 1 атм) |
||
Тпл = 209,7 К; |
|
|
|
Срж = 0,963 Дж/(г·К); |
Ткип = 334,4 К; |
|
|
|
Сргаз = 0,545 Дж/(г·К); |
∆Нпл = 9,211 кДж/моль; |
|
|
∆Нисп = 29,323 кДж/моль. |
|
3.9 Вычислить ∆G, ∆H, ∆F в процессе перехода 2 кг |
||||
С6Н6 |
→ |
С6Н6 |
||
(тв., 278,7 К, 1 атм) |
(газ, 400 К, 0,5 атм) |
|||
Тпл = 278,7 К; |
|
|
Срж |
= 1,842 Дж/(г·К); |
Ткип = 353,3 К; |
|
|
Сргаз = 1,046 Дж/(г·К); |
|
∆Нпл = 9,836 кДж/моль; |
|
∆Нисп = 30,774 кДж/моль. |
||
3.10 Определите ∆Н, ∆U, ∆G процесса перехода 1 моль: |
||||
Н2О |
→ |
|
Н2О |
|
(ж., 20 оС, 1 атм) |
|
(газ, 250 оС, 1 атм) |
||
Ср ж = 75,3 Дж/(моль·К); |
|
Сргаз = 35,98 Дж/(моль·К); |
||
∆Нисп воды при 100 оС и 1 атм составляет 40,67 кДж/моль. |
||||
3.11 Вычислить ∆G, ∆F, ∆H, если 1 кг |
||||
СН3 СООН |
→ |
|
СН3 СООН |
|
(тв., 290 К, 1 атм) |
|
(газ, 430 К, 1 атм) |
||
Тпл = 290 К; |
|
|
Срж = 2,057 Дж/(г·К); |
|
Ткип= 391,4 К; |
|
|
Сргаз = 1,197 Дж/(г·К); |
|
∆Нпл = 11,724 |
кДж/моль; |
|
∆Нисп = 24,410 кДж/моль. |
|
3.12Вычислить ∆G, ∆H, ∆U, ∆F для изотермического сжатия 1 моль идеального газа от Р1 = 5,065·105 до Р2 = 10,13·105 Па при 500 оС.
3.13Вычислить ∆G, ∆H, ∆U при нагревании 1 кмоль СНСI3 от 209,7 до 350 К, если
Тпл |
= 209,7 |
К; |
Срж = |
0,963 |
Дж/(г · К); |
Ткип. = 334,4 |
К; |
Срг = |
0,545 Дж/(г ·К); |
||
∆Нпл |
= 9,21 кДж/моль; |
∆Нисп = 18,3 |
кДж/моль. |
||
3.14 Вычислить ∆G, ∆F, ∆H для перехода 1 кг
23
С6Н5СН3 |
→ С6Н5СН3 |
|
|||||
(тв., 178,2 К, 1 атм) |
|
|
(газ., |
400 К, 3 атм) |
|||
Тпл |
= 178,2 К; |
|
|
Срж = 1,884 Дж/(г·К); |
|||
Т кип = 383,3 К; |
|
|
Сргаз = 1,281 Дж/(г·К); |
||||
∆Нпл = 6,624 кДж/моль; |
|
∆Нисп = 33,538 кДж/моль. |
|||||
3.15 Вычислить ∆ G, ∆Н, |
∆F для перехода 1 кг нафталина |
||||||
|
С10Н8 |
→ |
С10Н8 |
||||
(тв., 353,5 К, 1 атм ) |
|
|
|
( газ, 550 К, 1 атм) |
|||
Тплав. = 353,5 К; |
|
|
|
Срж |
= 2,094 Дж/(г·К); |
||
Ткип |
= 491,2 К; |
|
|
|
Ср газ = 1,023 Дж/(г·К); |
||
∆Нплав. = 19,3 кДж/моль; |
|
|
∆Нисп. = 43,5 кДж/моль. |
||||
3.16 Вычислить ∆G, ∆U, ∆F, если 1 моль |
|
||||||
НСООН |
→ |
НСООН |
|
||||
(тв., 281,2 К, 1 атм) |
|
(газ, 420 К, 2 атм) |
|||||
Тпл. = 281,2 К; |
|
|
Ср |
ж = 2,512 Дж/(г·К); |
|||
Ткип = 373,8 К; |
|
|
Ср |
газ = 1,371 Дж/(г·К); |
|||
∆Нпл = 3,17 кДж/моль; |
|
∆Нисп.=35,296 кДж/моль. |
|||||
3.17 Вычислить ∆H, ∆G, ∆U |
для перехода 1 моль |
||||||
|
С6Н5С2Н5 → С6Н5С2Н5 |
||||||
(тв., 286,5 К, |
1 атм) |
|
|
(газ, 430 К, 2 атм) |
|||
Тпл |
= 286,5 К; |
|
|
Срж = 1,964 Дж/(г·К); |
|||
Ткип = 411,4 К; |
|
|
Сргаз = 1,891 Дж/(г·К); |
||||
∆Нпл.= 17,125 кДж/моль; |
|
∆Нисп= 36,691кДж/моль. |
|||||
3.18 Вычислить ∆G, ∆F, ∆Н в процессе перехода 1 моль |
|||||||
(С2Н5)2 О |
|
→ |
|
(С2Н5)2О |
|||
(тв., 140 К, 1 атм) |
|
|
|
(газ, 350 К, 1 атм) |
|||
Тпл |
= 156,9 К; |
|
|
|
Ср |
ж = 2,215 Дж/(г·К); |
|
Ткип |
= 307,2 К; |
|
|
|
Ср |
газ = 1,934 Дж/(г·К); |
|
∆Нпл = 7,537 кДж/моль; |
|
|
∆Нисп = 26,713 кДж/моль. |
||||
3.19 Вычислить ∆Н, ∆U, ∆G для перехода 1 моль |
|||||||
С8Н10 |
→ |
С8Н10 |
|||||
(тв., 277,9 К, 1 атм) |
|
|
(газ, 430 К, 2 атм) |
||||
Тпл = 277,9 К; |
|
|
|
Ср |
ж = 1,717 Дж/(г·К); |
||
Ткип = 419,2 К; |
|
|
|
Ср |
газ = 1,296 Дж/(г·К); |
||
∆Нпл= 11,282 кДж/моль; |
|
|
∆Нисп = 36,720 кДж/моль. |
||||
3.20 Вычислить ∆Н, ∆F, ∆G для перехода 5 кг |
|||||||
Н2О |
→ |
Н2О |
|
||||
(тв., 273,2 К, 1 атм) |
|
|
(газ, 400 К, 2 атм) |
||||
24
Тпл = 273,2 К; |
|
|
Сртв = 0,570 |
Дж/(г·К); |
||
Т.кип. = 373,2 К; |
|
|
Срж = 4,184 |
Дж/(г·К); |
||
∆Нпл = |
6,138 кДж/моль; |
Сргаз = 1,919 Дж/(г·К); |
||||
∆Нисп = 45,069 кДж/моль. |
|
|
|
|||
3.21 Вычислить ∆Н, ∆U, ∆G для перехода 1 кг |
|
|||||
Br2 |
→ |
Br2 |
|
|||
(тв., 265,9 К, 1 атм) |
|
|
(газ, 360 К, 2 атм) |
|||
Тпл = 265,9 К; |
|
|
Срж = 0,461 |
Дж/(г·К); |
||
Т.кип. = 332,2 К; |
|
|
Сргаз = 0,225 Дж/(г·К); |
|||
∆Нпл = |
10,55 кДж/моль; |
∆Нисп = 30,7 кДж/моль. |
||||
3.22 Вычислить ∆G, ∆F, ∆H в процессе перехода 1 кг СНСl3 |
||||||
|
СНСl3 |
|
→ |
CHCl3 |
|
|
(тв. 209,7 К, 1 атм) |
|
(газ, 360 К, 2 атм) |
||||
Тпл = 209,7 К; |
|
|
|
Сжр = 0,963 Дж/(г·К); |
||
Ткип = 334,4 К; |
|
|
|
Сгазр = 0,545 Дж/(г·К); |
||
∆Нпл = 9,21кДж/моль; |
|
∆Нисп = 29,32 кДж/моль. |
||||
4.1 При |
|
|
|
Задача 4 |
|
|
постоянном |
давлении в первой системе энтальпия изменилась на |
|||||
100 кДж, а во второй - на 150 кДж при изменении энтропии на 400 Дж/К.
Указать знак |
изменения |
|
энтальпии. Какая |
система |
имеет |
большую |
температуру? |
|
|
|
|
|
|
4.2 При нагревании на 5 К |
энергия Гиббса при постоянном |
давлении |
||||
изменяется на |
400 Дж в |
первой системе и на |
650 Дж во второй. В какой |
|||
системе будет больше значение энтропии ? |
|
|
|
|||
4.3 Энтропия |
системы |
А |
равна 30 Дж/К, а системы |
В равна 80 Дж/К. |
||
Указать, в какой системе |
энергия Гельмгольца с ростом температуры |
|||||
убывает сильнее при постоянном объеме. |
|
|
|
|||
4.4При увеличении энтропии при постоянном давлении на 160 Дж/К в первой системе энтальпия изменилась на 10,0 кДж, а во второй на 20,0 кДж. Температура какой системы больше? Увеличилась или уменьшилась энтальпия?
4.5При увеличении температуры на 10 К при постоянном объеме энергия Гельмгольца изменилась на 400 Дж в первом случае и на 800 Дж во втором. Указать, в каком случае энтропия системы больше.
25
4.6В некоторой системе 1 с ростом температуры на 10 К энергия Гиббса изменяется на 100 Дж, а в системе 2 - на 200 Дж. Какая из систем обладает большей энтропией?
4.7При охлаждении от 400 до 200 К энергия Гельмгольца возросла от 350 до 710 Дж при постоянном объеме. Определить, чему равна средняя энтропия системы в этом интервале температур.
4.8При расширении газа от 5 до 10 л при постоянной температуре энергия Гельмгольца изменилась на 30 Дж, а при расширении от 15 до 20 л изменилась на 10 Дж. Указать знак изменения F и определить, в каком случае давление системы больше.
4.9 При постоянном объеме нагревается система от 250 до 500 К. Энтропия при этом увеличилась с 18 до 38 Дж/К. Увеличится или уменьшится при этом энергия Гельмгольца? Все данные в условии задачи изобразить на графике.
4.10Указать, где внутренняя энергия быстрее уменьшается с ростом объема при постоянной S, если в первой системе Р = 1 атм, а во второй системе 4 атм.
4.11При S = сonst произведено расширение газа от 10 до 40 л. Как при этом изменится (увеличится или уменьшится) внутренняя энергия системы и в каком состоянии давление будет больше?
4.12При повышении температуры на 20 К энергия Гиббса изменяется в системе А на 80 Дж, а в системе В - на 160 Дж. Какая из систем обладает большей энтропией?
4.13При увеличении давления на 1 атм при постоянной температуре энергия Гиббса изменяется в первом случае на 70 кДж, а во втором на 170 кДж. Указать, в каком случае объем системы больше?
4.14Указать, в какой системе внутренняя энергия быстрее убывает с ростом объема при постоянной S, если в первой системе Р = 2 атм, а во второй системе Р = 5 атм.
4.15При изменении энтропии на 100 Дж/моль при V = const внутренняя энергия первой системы увеличивается на 35,0 кДж, а второй на 60,0 кДж. В какой системе температура выше?
26

4-16 Дано: G
a
•α
•
• b
T
Чему равен tg α? В какой точке этот показатель будет больше?
4.17 Дано:
G
a |
α |
• |
|
b •
P
Чему равен tg α? В какой точке этот показатель будет больше?
4.18Дано: U
a •
b•
V
В какой точке давление в системе будет больше?
27
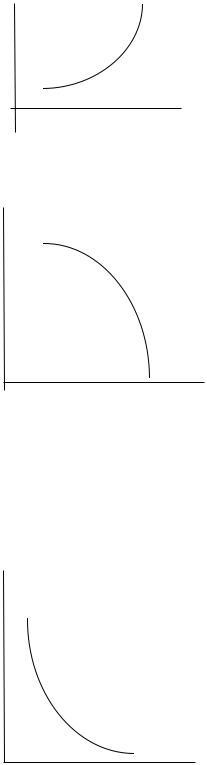
4.19 Дано: U
• b
• а
S
В какой точке температура системы будет выше?
4.20 Дано: F
• а
• b
Т
В какой точке энтропия системы будет больше?
4.21Указать, где внутренняя энергия быстрее уменьшается с ростом объема, если в первой системе Р = 5 атм, а во второй Р = 10 атм.
4.22Дано:
F
а •
b •
V
В какой точке давление в системе будет больше.
Задача 5 5.1 Вычислить фугитивность брома при Р = 10,13 МПа и Т = 1600 К.
28
5.2Вычислить фугитивность азота при Р = 12,16 МПа и Т = 400 К.
5.3Вычислить фугитивность кислорода при Р = 17,64 МПа и Т = 340,12 К.
5.4Вычислить фугитивность СО2 при Р = 13,17 МПа и Т = 457 К.
5.5Вычислить фугитивность НСl при Р = 15,58 МПа и Т = 457 К.
5.6Вычислить фугитивность хлора при Р = 12,16 МПа и Т = 900К. Определить число молей реального газа, занимающего объем 10 м3.
5.7Вычислить фугитивность аммиака при Р = 12,24 МПа и Т = 800 К. Определить число молей реального газа, занимающего объем 6 м3.
5.8Вычислить фугитивность Н2S при Р = 10,13 МПа и Т = 1000 К. Определить число молей реального газа, занимающего объем 7 м3.
5.9Вычислить фугитивность SО2 при Р = 13,17 МПа и Т = 1000 К. Определить число молей реального газа, занимающего объем 2 м3.
5.10Вычислить фугитивность SО3 при Р = 11,14 МПа и Т = 900К. Определить число молей реального газа, занимающего объем 1,5 м3.
5.11Вычислить фугитивность N2O при Р = 14,18 МПа и Т = 650 К. Определить число молей реального газа, занимающего объем 2,5 м3.
5.12Вычислить фугитивность N2O4 при Р = 11,14 МПа и Т = 1100 К. Определить число молей реального газа, занимающего объем 3,5 м3.
5.13Вычислить фугитивность СО при Р = 12,16 МПа и Т = 300 К. Определить число молей реального газа, занимающего объем 3,5 м3.
5.14Вычислить фугитивность NО при Р = 15,19 МПа и Т = 360,4 К. Определить число молей реального газа, занимающего объем 5 м3.
5.15Вычислить фугитивность СН4 при Р = 16,21 МПа и Т = 433 К. Определить число молей реального газа, занимающего объем 4,0 м3.
5.16Вычислить фугитивность ацетилена при Р = 11,14 МПа и Т = 443 К. Определить, какой объем занимают 10 кмолей реального газа.
5.17Вычислить фугитивность этилена при Р = 13,17 МПа и Т = 423 К. Определить, какой объем занимают 20 кмолей реального газа.
29

5.18Вычислить фугитивность этана при Р = 12,16 МПа и Т = 433 К. Определить, какой объем занимают 15 кмолей реального газа.
5.19Вычислить фугитивность пропена при Р = 10,13 МПа и Т = 1000 К. Определить, какой объем занимают 25 кмолей реального газа.
5.20Вычислить фугитивность пропана при Р = 16,21 МПа и Т = 1000 К. Определить, какой объем занимают 30 кмолей реального газа.
5.21Вычислить фугитивность бутана при Р = 14,18 МПа и Т = 1000 К. Определить, какой объем занимают 12 кмолей реального газа.
5.22Вычислить фугитивность бензола при Р = 15,19 МПа и Т = 1200 К. Определить, какой объем занимают 17 кмолей реального газа.
3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1.1 |
|
|
|
Задача 1 |
|
|
При 450 °С давление диссоциации NiO по уравнению |
||||||
2 NiO (тв.) |
2 Ni (тв.) + O2 |
|
||||
|
Кр = Р(О2) = 5,181·10-26 мм рт.ст. Пойдет ли разложение NiO на воздухе |
|||||
при |
|
парциальном давлении кислорода 0,203·105 Па? Чему будет равно ∆ G |
||||
для обратного процесса |
|
|
|
|||
|
|
Ni (тв.) +O2 |
2 NiO (тв.) в тех же условиях. |
|||
1.2 |
1/2 А (газ) + |
В (газ) |
|
2 С (газ) |
||
|
Рассчитать |
величину |
Кр и Кс |
при |
температуре, равной 400 К и |
|
равновесном давлении Р = 1,013·105 Па, |
если исходные количества веществ |
|||||
равны |
стехиометрическим |
соотношениям, |
а равновесное количество |
|||
вещества С равно 0,5 моль. |
|
|
|
|||
1.3 Пользуясь значениями константы равновесия Кр = 50 реакции |
||||||
|
|
Н2 |
+ I2 |
2 НI |
|
|
рассчитать сколько молей водорода надо взять на каждый моль йода, чтобы I2 при 444 °С на 90 % превратился в НI?
1.4 При 830 °С и 1,013·105 Па степень диссоциации Н2S согласно уравнению
2 Н2 + S2  2 Н2S
2 Н2S
равна 8,7 %. Определить константу равновесия Кр этой реакции.
1.5 В объеме 0,001 м3 находится 0,99 г фосгена при 600 °С. Общее давление равно 1,377·105 Па. Определить степень диссоциации, Кс реакции
СОСl2  СО + Сl2
СО + Сl2
30
