
- •Лабораторные работы по термодинамике и статистической физике Лабораторная работа № 5. Основные термодинамические процессы.
- •1. Изобарический процесс.
- •2. Изучение изобарического процесса.
- •Контрольное задание.
- •Контрольные вопросы.
- •3. Изохорический процесс.
- •4. Изучение изохорического процесса.
- •Контрольное задание.
- •Контрольные вопросы.
- •Контрольное задание.
- •Контрольные вопросы.
- •7. Адиабатический процесс.
- •8. Изучение адиабатического процесса.
- •Контрольное задание.
- •Контрольные вопросы.
Контрольные вопросы.
1. Что называют изотермическим процессом?
2. Сформулируйте закон Бойля-Мариотта.
3. Что называют изотермой? Изобразите изотерму в координатах P,V.
4. Как определяется работа при изотермическом расширении или сжатии?
5. Как записывается первый закон термодинамики для изотермического процесса?
Теперь можно перейти к четвертой части лабораторной работы.
7. Адиабатический процесс.

Адиабатический процесс - это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми стенками. Первый закон термодинамики для адиабатического процесса принимает вид
A = - U,
где U - изменение внутренней энергии. В адиабатическом процессе газ совершает работу за счет изменения внутренней энергии. Внутренняя энергия идеального газа изменяется пропорционально его температуре. Для 1 моля одноатомного газа
![]()
.
Здесь
![]()
м
 олярная
теплоемкость одноатомного газа при
постоянном объеме. Молярная теплоемкость
одноатомного газа при постоянном
давлении
олярная
теплоемкость одноатомного газа при
постоянном объеме. Молярная теплоемкость
одноатомного газа при постоянном
давлении
.
На плоскости (P,V) адиабаты изображаются семейством кривых
PV= const.
Э![]() то
соотношение называют
уравнением Пуассона.
Здесь
то
соотношение называют
уравнением Пуассона.
Здесь
- показатель адиабаты. Для одноатомного газа
![]()
.
Работа газа в адиабатическом процессе просто выражается через температуры T1 и T2 начального и конечного состояний:
A = Cv(T1-T2).
Следует помнить о том, что компьютерная модель соответствует одному молю идеального газа.
8. Изучение адиабатического процесса.
П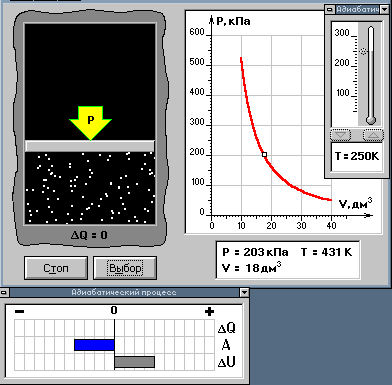 режде
чем приступить к выполнению конкретных
заданий, повторим основные правила
работы с данной компьютерной моделью.
После запуска четвертой части лабораторной
работы в левой части экрана монитора
должно появиться следующее окно
режде
чем приступить к выполнению конкретных
заданий, повторим основные правила
работы с данной компьютерной моделью.
После запуска четвертой части лабораторной
работы в левой части экрана монитора
должно появиться следующее окно
Нажмите на кнопку "Описание лабораторной работы" и дополнительно в правой половине экрана появится настоящее описание. В этом состоянии экрана вы будете выполнять работу.
Для установки начальных параметров заданий используйте линейки выбора. Для детального анализа сжатия и расширения газа при адиабатическом процессе применяйте пошаговое выполнение модели (см. "Работа с моделями").
Контрольное задание.
Теперь вам необходимо выполнить указанный преподавателем вариант задания из следующего списка. Измерения нужно проводить в пошаговом режиме работы модели. Если, согласно заданию, вы исследуете процесс расширения газа, то следует сначала сжать газ и только после этого в пошаговом режиме проводить измерения. Полученные результаты необходимо занести в лабораторную тетрадь.
Вариант 1. Моль идеального газа с одноатомными молекулами перешел адиабатически из состояния с температурой T1 = 280 K в состояние, характеризующееся параметрами: T2 = 322 K, P2 = 83 кПа, V2 = 32 л. Определить начальные давление P1 и объем V1 газа. Какую работу A совершает при этом сжатии газ?
Вариант 2. Моль одноатомного идеального газа, находящийся при начальной температуре T1 = 280 K, сжимают адиабатически до тех пор, пока давление не превзойдет начальное давление P1 в 10 раз. Каково отношение конечного и начального объемов газа?
Вариант 3. Моль идеального одноатомного газа, находившийся первоначально при температуре t1 = 7 oC, подвергается сжатию, в результате чего: а) объем газа уменьшается в 4 раза, б) давление газа увеличивается в 10 раз. Считая процесс сжатия адиабатическим, определить, до какой температуры t2 нагревается газ вследствие сжатия.
Вариант 4. Моль одноатомного газа, занимающий объем V1 = 40 л при температуре t1 = 17 oC, сжали адиабатически так, что давление его увеличилось в 3 раза. Определить конечные объем V2 и температуру t2 .
Вариант 5. Моль гелия (He), находившийся первоначально при температуре t1 = 27 oC и давлении P1 = 62 кПа, сжимают адиабатически до давления P2 = 622 кПа. Считая процесс сжатия обратимым, определить:
а) температуру газа T2 в конце сжатия,
б) работу A, совершаемую газом,
в) во сколько раз уменьшился объем газа.
Вариант 6. До какой температуры охладится моль одноатомного газа объема V1 = 10 л, взятый при T1 = 276 K, если объем его адиабатически увеличился в 3 раза?
Вариант 7. Моль одноатомного газа, занимающий объем V1 = 40 л при температуре t1 = 27 oC, сжали адиабатически так, что давление его увеличилось в 2 раза. Определить конечные объем V2, температуру t2 и изменение внутренней энергии газа.
Вариант 8. При адиабатическом расширении объем, занимаемый молем гелия, увеличивается от V1= 10 л до V2 = 20 л. Определить конечную температуру газа T2, если до расширения он имел температуру T1= 378 K.
Вариант 9. Моль одноатомного газа, объемом V1 = 10 л и давлением P1 = 398 кПа, адиабатически расширяется до объема V2 = 40 л, при этом давление уменьшается до P2 = 39 кПа. Определить начальную T1 и конечную T2 температуры газа.
Вариант 10. Моль одноатомного газа адиабатически сжимается от объема V1 = 40 л при температуре T1 = 240 K до объема V2 = 10 л, причем в конце сжатия установилось давление P2 = 503 кПа. Под каким давлением P1 находился газ до сжатия и какова температура газа T2 в конце сжатия?
Вариант 11. Моль одноатомного газа, находящийся при температуре t1 = 17 oC и давлении P1 = 60 кПа, сжимается адиабатически от объема V1 до объема V2 = 0,5V1. Найти температуру t2 и давление P2 газа после сжатия.
Вариант 12. До какой температуры T2 охладится моль одноатомного газа, находящийся при температуре T1 = 277 K, если он расширится адиабатически от объема V1 до объема V2 = 2V1?
