
- •Ответы на вопросы переченя
- •Методы получения важнейших веществ в химической промышленности и в лабораторной практике
- •Вопрос 1. Натрий, гидроксид натрия, карбонат натрия.
- •Вопрос 2. Оксид, гидроксид кальция, хлорная известь
- •Вопрос 3. Бор, борная кислота; алюминий, оксид и гидроксид алюминия
- •Вопрос 4. Оксиды углерода; кремний, силикаты, стекло.
- •Вопрос 5. Аммиак, азотная кислота, нитраты калия и аммония; фосфор, фосфорная кислота, фосфорные удобрения.
- •Вопрос 6. Водород, хлор, бром, фторводород, хлороводород, хлорат калия.
- •Вопрос 7. Кислород, сероводород, оксиды серы, серная кислота.
- •Вопрос 8. Титан, оксид титана.
- •Вопрос 9. Хром, марганец, железо, никель.
- •Вопрос 10. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
Вопрос 7. Кислород, сероводород, оксиды серы, серная кислота.
Кислород самый распространённый элемент земной коры. Молекула кислорода двухатомна (O2). Простое вещество – молекулярный кислород – представляет собой газ без цвета и запаха, плохо растворимый в воде. В атмосфере Земли содержится 21 % (по объёму) кислорода. В природных соединениях кислород встречается в виде оксидов (H2O, SiO2) и солей оксокислот. Одно из важнейших природных соединений кислорода – вода, или оксид водорода H2O.
Помимо оксидов, кислород способен образовывать пероксиды – вещества, содержащие следующую группировку атомов: –O–O– . Один из важнейших пероксидов – пероксид водорода H2O2 (H–O–O–H). В пероксидах атомы кислорода имеют промежуточную степень окисления минус 1, поэтому эти соединения могут быть как окислителями, так и восстановителями:
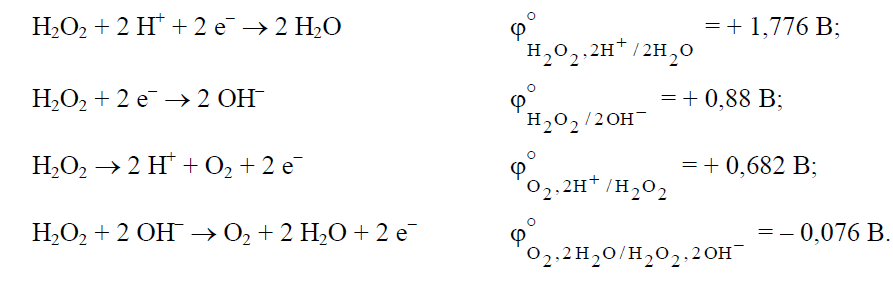
Из величин стандартных электродных потенциалов следует, что окисли
тельные свойства H2O2 наиболее сильно проявляются в кислой среде, а восстановительные – в щелочной. Например, пероксид водорода в кислой среде способен окислять те вещества, стандартный потенциал электрохимической системы которых не превышает +1,776 В, и восстанавливать только те, у которых потенциал больше +0,682 В.
Аллотропной модификацией кислорода является озон (O3) – газ со специфическим запахом. Озон получают действием «тихих» электрических разрядов на кислород в специальных приборах – озонаторах. Реакция превращения кислорода в озон требует затраты энергии:
3O2 ↔ 2O3 – 285 кДж .
Обратный процесс – распад озона – протекает самопроизвольно.
Озон – один из сильнейших окислителей; по окислительной активности он уступает только фтору.
При высокой температуре сера взаимодействует с водородом с образованием сероводорода (H2S) – бесцветного газа с характерным запахом гниющего белка. Поскольку эта реакция обратима, то на практике сероводород обычно получают действием разбавленных кислот на сульфиды металлов:
FeS + 2 HCl → H2S↑ + FeCl2 .
Сероводород – сильный восстановитель; при поджигании на воздухе горит голубоватым пламенем:
2 H2S + 3 O2 → 2 SO2 + 2 H2O (в избытке кислорода).
Поэтому смесь сероводорода с воздухом взрывоопасна. При недостатке кислорода сероводород окисляется только до свободной серы:
2 H2S + O2 → 2 S + 2 H2O .
Сероводород очень ядовит и способен вызвать тяжёлые отравления.
Раствор сероводорода в воде обладает свойствами слабой двухосновной кислоты (К1 = 6×10–8, К2 = 1×10–14). Средние соли сероводородной кислоты – сульфиды – можно получить непосредственным взаимодействием металлов с серой. Малорастворимые сульфиды можно получить, действуя сероводородом на растворы солей соответствующих металлов:
CuSO4 + H2S CuS+ H2SO4 .
Оксид серы (IV) образуется при горении серы на воздухе:
S + O2 → SO2 .
В промышленности SO2 получают при обжиге сульфидов и полисульфидов металлов, а также термическим разложением сульфатов (в частности CaSO4):
![]()
Диоксид серы – бесцветный газ с запахом жжёной серы. SO2 хорошо растворяется в воде, образуя сернистую кислоту:
![]()
Сернистая кислота – слабая двухосновная кислота (К1=1,6×10–2, К2=6×10–8). H2SO3 и её соли являются хорошими восстановителями и окисляются до серной кислоты или сульфатов:

При высокой температуре в присутствии катализатора (V2O5, сплавы на основе платины) диоксид серы окисляется кислородом до триоксида:
![]()
Оксид серы (VI) – это ангидрид серной кислоты:
![]()
В газообразном состоянии оксид серы (VI) состоит из молекул SO3, построенных в форме правильного треугольника. При конденсации паров SO3 образуется летучая жидкость (t кипения = +44,8 °C), состоящая преимущественно из тримерных циклических молекул. При охлаждении до +16,8 °C она затвердевает, и образуется так называемая льдовидная модификация SO3 . При хранении она постепенно превращается в асбестовидную модификацию SO3, состоящую из полимерных молекул.

Концентрированная серная кислота, особенно горячая, – энергичный окислитель. Она окисляет бромид- и иодид-ионы до свободных галогенов, уголь – до углекислого газа, серу – до SO2. При взаимодействии с металлами концентрированная серная кислота переводит их в сульфаты, восстанавливаясь до SO2, S или H2S. Чем более активен металл, тем более глубоко восстанавливается кислота.
Например, при взаимодействии концентрированной серной кислоты с медью преимущественно выделяется SO2; при взаимодействии с цинком может наблюдаться одновременное выделение и оксида серы (IV), и свободной серы, и сероводорода:

H2SO4 – сильная двухосновная кислота, диссоциированная по первой стадии
практически нацело; диссоциация по второй стадии протекает в меньшей степени, однако в разбавленных водных растворах серная кислота диссоциирована практически нацело по схеме:
H2SO4 → 2 H+ + SO42-
Большинство солей серной кислоты хорошо растворимо в воде. К практически нерастворимым относятся BaSO4 , SrSO4 , PbSO4; малорастворим CaSO4. Качественная реакция на ионы SO4 2– обусловлена образованием малорастворимых сульфатов. Например, при введении ионов бария в раствор, содержащий сульфатионы, выпадает белый осадок сульфата бария, практически нерастворимый в воде и разбавленных кислотах:
Ba2+ + SO42-→ BaSO4↓ .
Серную кислоту применяют в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах; для получения различных минеральных кислот и солей; в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ; в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности и т.д.
