
ПромВВ
.pdfстоящей из корпуса с двойными стенками, образованными дву- мя ампулами. Межампульное пространство шириной 4-5 мм за- полнено 50-65%-ным раствором аммиачной селитры. Раствор аммиачной селитры увеличивает фугасное действие взрыва за- ряда и выполняет роль пламегасителя, а полиэтиленовая обо- лочка повышает класс предохранительности, обеспечивает вы- сокую водоустойчивость, способствует более устойчивому и полному протеканию детонации ВВ ядра в оболочке. Основные характеристики патронов в предохранительных оболочках при- ведены в табл.19.
Таблица 19 - Характеристика марки патронов
Характеристика |
Марка патронов |
|||
ПВП-1-У |
ПВП-1-А |
СП-1 |
||
|
||||
Класс предохранительности ВВ в ядре |
V |
V |
VI |
|
(оболочке) |
||||
|
|
|
||
Взрывчатое вещество ядра |
аммонит |
ПЖВ- |
угле-нит- |
|
20 |
Э6 |
|||
|
|
|||
Масса ядра, г |
120 |
175 |
200 |
|
|
|
|
|
|
Плотность ВВ, г/см3 |
1,05-1,15 |
1,05- |
1,1- |
|
|
|
1,15 |
1,25 |
|
Скорость детонации, км/с |
4,2-4,5 |
3,8-4,5 |
2,0-2,5 |
|
|
|
|
|
|
Техническая норма предохранительности: |
|
|
трех па- |
|
не воспламеняет метан при подрыве |
одного патрона |
тронов в |
||
не воспламеняет пыль при подрыве |
трех свободно под- |
уголковой |
||
|
вешенных патронов |
мортире с |
||
|
|
|
отража- |
|
|
|
|
тельной |
|
|
|
|
стенкой |
|
Патроны ПВП-1-У, ПВП-1-А и СП-1, благодаря высокой водоустойчивости, пригодны для взрывания в обводненных за- боях. Их можно применять в различных климатических районах страны. Недостатки патронов – сложность и трудоемкость их изготовления.
71
9. Кислородный баланс и реакции превращения взрывчатых веществ
Рецептуры ВВ составляют с таким расчетом, чтобы при ре- акции взрыва образовывались в основном пары воды, азот и уг- лекислый газ, т.е. газообразные продукты наименее опасные для человека. Когда в составе ВВ наблюдается недостаток или из- быток кислорода по сравнению с необходимым его количест- вом, при взрыве образуются соответственно ядовитые окись уг- лерода и окислы азота. Образование ядовитых газов зависит так- же от полноты детонации заряда, что, в свою очередь, определя- ется правильностью заряжания и выбранными размерами заря- да.
Отравляющее действие окиси углерода СО (угарного газа) объясняется его способностью образовывать при вдыхании прочные соединения с красными кровяными тельцами, являю- щимися переносчиками кислорода из легких к тканям, вследст- вие чего человеческий организм начинает испытывать кисло- родное голодание, и при больших концентрациях в крови (СО> 1%) быстро наступает смерть.
Окислы азота NO, NO2 при вдыхании образуют в легких азотную и азотистую кислоты, действие которых приводит к отеку легких и смерти. Особую опасность окислы азота пред- ставляют из-за того, что они накапливаются в организме. По- этому по своему токсическому действию они считаются в 6,5 раз более ядовитыми, чем окись углерода.
Кислородный баланс характеризуется отношением избытка или недостатка кислорода в составе ВВ к его количеству, необ- ходимому для полного окисления горючих элементов ВВ.
Кислородный баланс наиболее просто определяется отно- шением грамм-атомной массы избытка или недостатка кислоро- да к грамм-молекулярной массе ВВ.
Различают нулевой, положительный и отрицательный ки- слородный баланс.
72

Кислородный баланс считается нулевым, если в составе ВВ содержится количество кислорода, необходимое для полного окисления горючих компонентов. Если в составе ВВ не хватает кислорода для полного окисления горючих элементов, то такое ВВ имеет отрицательный, а при избытке кислорода – положи- тельный кислородный баланс.
При взрыве ВВ с нулевым кислородным балансом образу- ется минимальное количество ядовитых газов и выделяется мак- симальное количество энергии. При недостатке кислорода обра- зуется ядовитая окись углерода. Образование этого соединения идет с меньшим выделением тепла (27,17 ккал/к×моль), чем при образовании двуокиси углерода (94,5 ккал/к×моль). При избытке кислорода последний образует с азотом весьма ядовитые окис- лы. Реакции образования окислов азота эндотермичны, т.е. про- текают с поглощением тепла. Таким образом и в этом случае ко- личество тепла, выделившееся при взрыве единицы массы взрывчатого вещества, будет меньше, чем при нулевом кисло- родном балансе.
Если ВВ имеет элементарный состав СаНвNcOd, то кисло- родный баланс можно выразить в процентах избытка или недос- татка кислорода для полного окисления горючих элементов (уг- лерода и водорода) в молекуле ВВ. Углерода до СО2, т.е. на один атом углерода требуется два атома водорода, а водорода до Н2О – на один атом водорода требуется 1/2 атома кислорода
KБ = d − (2a + в / 2) ×16 ×100%,
M
где 16 – атомная масса кислорода; М – молекулярная масса ВВ. Для взрывчатых смесей расчет можно вести на один кило- грамм, тогда в числитель дроби войдет количество грамм-молей соответствующих элементов, содержащихся в 1 кг смесевого
ВВ, а в знаменатель - 1000 вместо М.
73

Пример. Определить кислородный баланс нитроглицери- на, формула которого C3H5(ONO2)3.
Для полного окисления 3 атомов углерода (в углекислоту СО2) требуется 6 атомов кислорода, а для окисления 5 атомов водорода (в воду Н2О) – 2,5 атома кислорода, всего 8,5 атомов кислорода. В нитроглицерине содержится 9 атомов кислорода, т.е. имеется избыток кислорода (0,5 атома), значит кислородный баланс положительный.
Грамм-атомная масса избытка 0,5 атома кислорода равна 0,5×16=8, а грамм-молекулярная масса нитроглицерина равна 227. Таким образом, кислородный баланс нитроглицерина
KБ = 9 − (6 + 2,5) ×16 ×100 = 3,52% . 227
Расчет кислородного баланса ВВ, представляющего собой смесь нескольких химических соединений (Кбсм) производится суммированием произведения доли каждого компонента на его кислородный баланс
100 × КБсм = КБа × а + КБв × в + × × × + КБi × i,
где а, в, …, i – доля каждого компонента, %; КБа, КБв, …, КБi – кислородный баланс каждого компонента.
Зная кислородный баланс исходных компонентов (табл.20), можно составить смесевое ВВ с любым кислородным балансом.
Таблица 20 - Кислородный баланс некоторых ВВ и их ком- понентов
|
|
|
|
Теплота |
|
|
|
Атомная |
Кисло- |
образования |
|
Вещество |
|
или мо- |
родный |
при посто- |
|
Химическая |
лекуляр- |
янном |
|||
|
баланс, % |
||||
|
формула |
ная масса |
объеме, |
||
|
|
|
|
ккал/г×моль |
|
1 |
2 |
3 |
4 |
5 |
|
|
Химические соединения |
|
|
||
Алюминий |
Al |
27 |
-89 |
- |
|
Аммиачная селитра |
NH4NO3 |
80 |
+20 |
84,75 |
|
74
Продолжение табл.20
1 |
2 |
3 |
4 |
5 |
|
Бумага (оболочка |
|
|
|
|
|
патронов) |
- |
- |
-130 |
- |
|
Гексоген |
C3H6N6O6 |
222 |
-21,6 |
-20,86 |
|
Гремучая ртуть |
Hg(CNO)2 |
284 |
-11,3 |
-65,3 |
|
Динитрогликоль |
|
152 |
0 |
55,75 |
|
Динитронафталин |
C10H6(ONO2)2 |
218 |
-139,4 |
-9,4 |
|
Калиевая селитра |
KNO3 |
101 |
+30,6 |
116,95 |
|
Калия хлорат |
KClO3 |
122,6 |
+39,2 |
93,2 |
|
Калия перхлорат |
KClO4 |
138,5 |
+46,2 |
104,5 |
|
Керосин |
- |
- |
-343 |
- |
|
Клетчатка |
C6H10O5 |
162 |
-118,5 |
230,3 |
|
Магний |
Mg |
25.3 |
-65,8 |
- |
|
Мука злаков |
C15H25O11 |
381 |
-132 |
- |
|
Мука древесная |
C15H22O10 |
362 |
-137 |
4690* |
|
Натриевая селитра |
NaNO3 |
85 |
+47 |
11,72 |
|
Натрия хлорат |
NaClО3 |
106,5 |
+45 |
83,6 |
|
Натрия перхлорат |
NаClO4 |
122,5 |
+52,2 |
93,0 |
|
Нитроглицерин |
C3H5(ONO2)3 |
222 |
+3,5 |
83,71 |
|
Нитроклетчатка |
|
|
|
|
|
(коллоидная) |
C24H31NgO38 |
1105,3 |
-38,7 |
661,9 |
|
Нитроклетчатка |
|
|
|
|
|
(пироксилин) |
C24H29N11O42 |
1143 |
-28,6 |
570,7 |
|
Парафин (твердый) |
C24H50 |
338,5 |
-346 |
11190* |
|
Пикриновая кислота |
C6H2(NO2)3O |
229 |
-45,4 |
54,4 |
|
|
H |
|
|
|
|
Тетранитрометан |
C(NO2)4 |
196 |
+49 |
-8,4 |
|
Тетрил |
C6H2(NO2)4N |
287 |
-47,4 |
-9,91 |
|
CH3 |
|||||
|
|
|
|
||
Тротил |
C7H5(NO2)3 |
227 |
-74 |
17,5 |
|
ТЭН |
C5H8(ONO2)4 |
316 |
-10,1 |
122,41 |
|
Углерод (аморф- |
C |
12 |
-266,7 |
8130* |
|
ный) |
|
|
|
|
|
Вода (пар) |
H2O |
18 |
- |
57,8 |
|
Окись алюминия |
Al2O3 |
102 |
- |
98,1 |
|
Окись кальция |
CaO |
56 |
- |
150,8 |
75

Окончание табл.20
1 |
2 |
3 |
4 |
5 |
|
Окись азота |
NO |
30 |
- |
22,6 |
|
Окись углерода (газ) |
CO |
28 |
- |
27,17 |
|
Углекислота (газ) |
CO2 |
44 |
- |
94,51 |
|
Целлюлоза |
C10H6O6 |
162 |
- |
226 |
|
|
Взрывчатые смеси |
|
|
||
Аммонит № 6-ЖВ |
- |
- |
-0,64 |
- |
|
Аммонит № 7-ЖВ |
- |
- |
+0,2 |
- |
|
Аммонит АП-5-ЖВ |
- |
- |
+0,37 |
- |
|
62%-ный трудноза- |
|
|
|
|
|
мерзающий дина- |
- |
- |
+0,3 |
- |
|
мит |
|||||
|
|
|
|
||
Аммонит ПЖВ-20 |
- |
- |
+0,72 |
- |
|
Аммонит № 9-ЖВ |
- |
- |
+2,9 |
- |
|
Аммонит № 10-ЖВ |
- |
- |
+1,5 |
- |
|
Примечание: * теплота сгорания вещества, кал/г.
Расчет смесей очень прост и производится следующим об- разом. Пусть имеется одно вещество «а», кислородный баланс которого положителен и равен КБа, %, а другое – « в», кислород- ный баланс которого отрицателен и равен КБв, %.
Обычно расчет ведут на 1 кг смеси. Для приготовления 1000 г смеси с нулевым кислородным балансом нужно взять «а» частей первого вещества и «в» частей – второго.
Основные условия при этом следующие:
а× КБа - в× КБв = 0 и а + в = 1000.
Отсюда а = 1000 – в, тогда (100 - в) × КБа - в× КБв = 0 .
После некоторого преобразования найдем, что
в = |
1000 × КБа |
; |
а = |
1000 × КБв |
|
КБа + КБв |
|
КБа + КБв |
|
или
а = 1000 - 1000 × КБа .
КБа + КБв
76

|
|
|
Следовательно, для смеси нужно взять |
1000× КБв |
|
вещест- |
|||||||
|
|
|
КБа + КБв |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
ва «а» и |
1000 × КБа |
|
вещества «в». |
|
|
||||||||
КБа + КБв |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
В |
процентах |
для смеси нужно взять компонента |
||||||||
а = |
|
100 × КБв |
, а |
компонента в = 100 - |
100 × КБв |
|
или |
||||||
|
|
|
|
|
|
||||||||
|
|
КБа + КБв |
|
|
КБа + КБв |
||||||||
|
100 × КБа |
%. |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||||
|
КБа |
+ КБв |
|
|
|
|
|
|
|||||
Иногда приходится готовить смесь с заданным отрица- тельным или положительным кислородным балансом. Для этой цели можно воспользоваться следующей формулой:
а = |
100 × (КБв - КБс ) |
или в = |
100 × (КБа - КБс ) |
, |
(1) |
|
|||||
|
КБа + КБв |
|
КБа + КБв |
|
|
где КБс – заранее заданный кислородный баланс смесей, %.
10. Примеры составления взрывчатых смесей
1. Составить смесь с нулевым кислородным балансом из тринитронафталина и аммиачной селитры.
Решение. Сначала вычисляют кислородный баланс компо- нентов. Для тринитронафталина
O2
C10H5(NO2)3 10CO2+2,5H2O+1,5N2
Из уравнения видно, что присутствует шесть атомов ки- слорода, а для сгорания горючих элементов необходимо 10×2 + 2,5= = 22,5 атома.
Значит, в тринитронафталине не хватает 6 – 22,5 = -16,5 атома кислорода:
77

КБа = − 16 ×16,5 ×100 = −100,4%. 263
Знак минус ставится в случае недостатка кислорода. Здесь 263 – молекулярная масса тринитронафталина.
Для аммиачной селитры
NH4NO3=2H2O+N2+0,5O2
избыток кислорода будет равен:
КБв = 16 ×1×100 = 20%, 80
где 80 – молекулярная масса аммиачной селитры. Следовательно, аммиачную селитру необходимо взять в
количестве |
|
|
|
|
|
|
|
|
в = |
КБа |
×100 = |
100,4 ×100 |
= 83,39%, |
||||
|
|
|
|
|
||||
КБа |
+ КБв |
100,4 |
+ 20 |
|||||
|
|
|
||||||
а тринитронафталина 100 – 83,39 = 16,61% или соответственно
833,9 и 166,1 г.
Затем проверяют правильность составления смеси. Для этого вначале определяют молекулярные соотношения компо- нентов для одного килограмма смеси:
833,9 : 80 = 10,5 моль; 166,1 : 263 = 0,63 моль.
Данному соотношению компонентов смеси соответствует уравнение сгорания
0,63C10H5(NO2)3+10,5NH4NO3=6,3CO2+22,5H2O+11,45N2
В смеси имеется 0,63×6 + 10,5×3 = 35,28 атома кислорода, а на сгорание потребуется 6,3×2 + 22,58 = 35,18 атома кислорода.
Следовательно, данная смесь составлена правильно. Раз- ница 0,1 получилась за счет округления при расчетах.
78

2. Составить смесь с нулевым кислородным балансом из тетранитрометана и ксилила.
Решение. Находят кислородный баланс компонентов для тетранитрометана
C(NO2)4=CO2+2N2+3O2
КБа = 16 × 6 ×100 = 49% 196
и для ксилила
C6H(NO2)3(CH3)2 O2 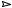 8CO2+3,5H2O+1,5N
8CO2+3,5H2O+1,5N
В результате имеется 6 атомов кислорода, а необходимо
8×2 + 3,5 = 19,5 атома
КБв = − 16 ×13,5 ×100 = −89%. 241
Отсюда тетранитрометана нужно
a = |
100 ×89 |
= |
8900 |
= 64,5%, |
|
|
|||
89 + 49 |
138 |
|
||
а ксилила 100 – 64,5 = 35,5%.
Проверяют правильность составления смеси, для чего на- ходят молекулярные соотношения компонентов:
645 : 196 = 3,8 и 335 : 241 = 1,47 или
1,47C6H(NO2)3(CH3)2+3,8C(NO2)4= 15,06CO2+5,15H2O+8,8N2.
Следовательно, имеется кислорода в смеси 3,8×8 +1,47×6 =
=35,22 атома, а для сгорания необходимо кислорода 15,0×2 +
+5,15=35,27 атома.
Данная смесь составлена правильно.
79

3. Составить смесь с нулевым кислородным балансом из нитроглицерина и двенадцатиазотного пироксилина.
Решение. Находят кислородный баланс компонентов для нитроглицерина
C3H5(ONO2)3=3CO2+2,5H2O+1,5N2+0,25O2
КБа = 16 ×0,5 ×100 = 3,52% . 227
и для пироксилина
C24H28O8(ONO2)12 O3 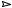 24CO2+14H2O+6N2
24CO2+14H2O+6N2
|
КБб |
= |
|
16 ×18 ×100 |
= 24,236%. |
|
|||
|
|
||||||||
|
|
|
1188,3 |
|
|
|
|
||
Необходимо взять нитроглицерина |
|
||||||||
а = |
100 × КБб |
|
= |
100 × 24,236 |
= - |
2433,6 |
= 87,3%, |
||
КБа + КБб |
|
|
|||||||
|
3,52 + 24,236 |
27,756 |
|
||||||
а пироксилина 100 – 87,3 = 12,7%.
Проверяют правильность расчета смеси, для чего находят молекулярные соотношения компонентов и пишут уравнение сгорания:
873 : 227 = 3,84; 127 : 1188,3 = 0,107.
3,84C3H5(ONO2)3+0,107C24H28O8(ONO2)12= 14,088CO2+11,1H2O+6,4N2.
Следовательно, имеются кислорода 39,208 атома, а необ- ходимо – 39,266 атомов. Данная смесь составлена правильно с небольшой погрешностью.
4. Составить смесь из аммиачной селитры и динитронафта- лина с тем, чтобы кислородный баланс ее был отрицательный
(-10%).
Решение. Кислородный баланс компонентов смеси будет следующим:
для аммиачной селитры КБа = 20% (см.пример 1);
80
