
teorosnobesvr
.pdfНАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
флотационной очистки как за счёт частичной гидрофобизации частиц
(увеличения краевого угла ), так и появления более крупных частиц,
которые обладают большой флотационной способностью.
В некоторых случаях флотируются и полностью смачиваемые водой частицы. Привлечение представлений о гетерокоагуляции (взаимодействие пузырёк-частица) даёт объяснение этим фактам. Причиной закрепления частиц на пузырьках воздуха в этом случае является наличие второй потенциальной ямы (и, следовательно, сил притяжения) на значительных расстояниях между пузырьком воздуха и частицей, разделённых прослойкой воды. Это относится, однако, только к мелким частицам, гидродинамические силы отрыва для которых от всплывающего пузырька и силы тяжести не превышают сил притяжения частицы к пузырьку.
3.5. Молекулярная адсорбция
Для удаления из воды молекулярно растворенных компонентов широко применяется метод адсорбции. Поглощающей фазой (адсорбентом)
обычно является активированный уголь, обладающий высокой удельной поверхностью (сотни м2/г), на которой происходит адсорбция.
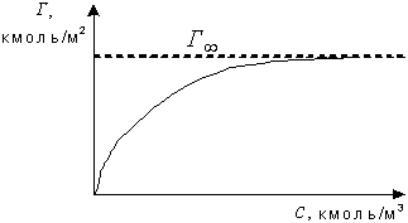
При установлении адсорбционного равновесий в системе соотношение между количеством поглощенного вещества - Г (в г или моль на 1 м2 поверхности адсорбента) и равновесной концентрацией этого вещества в воде - с описывается уравнением Ленгмюра (рис. 3.14).
51
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
|
|
|
|
|
|
|
Рис. 3.14. Изотерма адсорбции |
|
|
|
|
||
|
|
|
|
|||
|
|
|
|
|
|
|
|
Г Г |
кс |
(3.19) |
|||
1 кс |
||||||
|
|
|
||||
где Г∞ - максимальная адсорбция; к - константа равновесия.
Из уравнения (З.19) следует, что при кс << 1 существует линейная связь между Г и С :
Г = Г∞ ·кс. |
(3.20) |
При условии кс >> 1 (большая концентрация - с или значительная величина константы к) уравнение упрощается до Г = Г∞ , т.е. величина адсорбции максимальна и не зависит от концентрации адсорбируемого компонента. Физический смысл этого прост - все активные места адсорбента,
на которых может произойти адсорбция, уже заняты адсорбированными молекулами.
Величины Г∞ и к могут быть найдены на основании экспериментальных данных и уравнения (3.19). Наиболее простой способ нахождения Г∞ и к состоит в линеаризации уравнения (3.19), которое приобретает вид
с |
|
1 |
|
1 |
с |
. |
(3.21) |
|
Г к |
|
|||||
Г |
|
Г |
|
||||
52

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Прямая линия, не проходящая через начало координат (рис. 3.15), позволяет по углу наклона – α (ctgα) найти Г∞ и далее по отрезку, отсекаемому на оси ординат – к.
Рис.3.15. Линеаризованная форма изотермы адсорбции Ленгмюра
Для описания процесса адсорбции часто пользуются эмпирическим уравнением Фрейндлиха:
Г кс1/ n , |
(3.22) |
где к и 1/n - константы.
Логарифмирование уравнения (3.22) приводит к линейной зависимости:
lgГ lgК |
1 |
lgC. |
(3.23) |
|
|||
|
n |
|
|
Отрезок, отсекаемый на оси ординат, соответствует lgК, а тангенс угла наклона прямой - 1/n (рис 3.16).
53

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Рис.3.16. Изотермы адсорбции Фрейндлиха в двойном логарифмическом масштабе
При равновесной концентрации c, равной 1, величина адсорбции равна к.
Таким образом, к характеризует активность адсорбента по отношению к адсорбируемому компоненту.
Молекулярно-растворенные вещества обладают различной адсорбционной способностью. Согласно правилу Дюкло-Траубе, в
гомологическом ряду (спиртов, органических кислот), увеличение длины углеводородной цепи (молекулярной массы) приводит к росту величины адсорбции. Это правило соблюдается при адсорбции на границе раздела жидкость-пар (газ). Для границы раздела твердое тело-жидкость (вода)
возможно обращение этого правила - рост молекулярной массы может приводить к уменьшению величины адсорбции. Это может быть связано с ростом недоступности части поверхности адсорбента (тонких пор) для более крупных молекул.
Еще одним компонентом, от которого должна быть очищена вода,
являются растворенные электролиты (соли, кислоты, щелочи). Это наиболее трудная задача, однако без ее решения вода часто не может быть возвращена в производство или сброшена в водоем. Для решения этой задачи используются следующие методы: ионный обмен, электродиализ и гиперфильтрация (обратный осмос).
54

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
3.6. Ионный обмен
Ионный обмен - это один из методов удаления примесей,
находящихся в ионной форме, основанный на процессе ионообменной адсорбции. Сущность его состоит в следующем. Любая частица, находящаяся в воде, несет на себе заряд. Избыток ионов противоположного знака
(противоионов) находится вблизи заряженной частицы и компенсирует ее заряд. Если в воду ввести электролит, то его ионы могут обмениваться местами с противоионами, окружающими частицу. Этот обмен протекает в строго эквивалентных количествах и может быть представлен следующей схемой (рис. 3.17):
Рис.3.17. Схема обмена ионов
Хотя обмен ионов протекает в эквивалентных количествах,
адсорбционная способность отдельных ионов различна. Так, в случае почв,
частицы которых заряжены отрицательно, катионы по своей адсорбционной способности располагаются в следующий ряд: Al3+ > Ba2+ > Ca2+ > Mg2+ > K+ > Na+ > Li+. Приведенный ряд показывает, что чем больше заряд иона и меньше его гидродинамический радиус, тем больше вероятность перехода этого иона
55
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
из раствора и диффузного слоя в адсорбционный слой и вытеснение им одноименно заряженного иона в раствор.
Вещества, способные к обмену ионов, характеризуются емкостью обмена - количеством грамм-эквивалентов ионов, которое может быть поглощено (обменено) одним килограммом ионообменника. Применяемые в настоящее время на практике ионообменники обладают емкостю обмена,
составляющей 1-10 г-экв./кг.
При достижении термодинамического равновесия между ионообменником и жидкой средой (водой), в которой присутствует электролит, справедливо следующее соотношение, полученное Никольским:
|
1 |
|
1 |
|
1 |
|
1 |
(3.24) |
g 1z1 |
/ g 2z2 |
ka 1z1 |
/ a 2z 2 |
|||||
где g1 и g2 - количества грамм-эквивалентов первого и второго иона в адсорбированном состоянии; a1 и a2 - активности ионов 1 и 2 в растворе; к -
константа обмена; z1 и z2 - валентности ионов 1 и 2.
Широкое применение на практике в качестве ионообменников нашли ионообменные смолы - продукты полимеризации и поликонденсации мономеров, содержащие ионогенные группы (-СООН, - SО3Н, аминогруппы
–NR3, =NH, ≡N). Различают катиониты - ионообменники, способные к обмену катионов, и аниониты - обменивающие анионы.
Ионообменные смолы широко используются для умягчения воды
(удаления ионов Ca2+ и Mg2+), а также для практически полного удаления растворенных электролитов. В последнем случае полученная вода имеет название "деионизированная" или "деминерализованная".
Процесс удаления из воды электролитов может быть записан следующим образом:
ПкН + NaCl→ ПкNa + HCl |
и далее |
ПаОН + НCl →ПаCl + H2O |
|
56
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Обрабатываемая вода пропускается через катионит, находящийся в Н-
форме (ПкН) и далее черев анионит в ОН-форме (ПаОН). После израсходования всей (или части) обменной емкости ионитов (замещения Н и ОН ионов на ионы Na и Сl) они могут быть регенерированы путем пропускания через колонки с ионообменными смолами раствора кислоты
(через катионит в Na-форме) и щелочи (через анионит в С1-форме) c
последующей их отмывкой водой.
Возможно использование смеси катионита и анионита в одном аппарате. Это значительно упрощает (конструктивно) процесс удаления примесей, однако приводит к более сложному процессу регенерации смешанного ионообменника. Для проведения регенерации необходимо разделение смеси на компоненты (катионит и анионит), их раздельная регенерация и далее получение смеси ионообменников в Н и ОН формах.
Приведенные выше затруднения процесса регенерации смеси ионообменных материалов могут быть решены путем использования процесса электродиализа.
3.7. Электродиализ
Электродиализом называется процесс очистки воды от электролитов при пропускании через нее электрического тока. На рис.3.18 а представлен процесс электролиза водного раствора сульфата натрия. Приложение разности потенциалов вызовет перемещение катионов к катоду, а анионов к аноду. Продукты электролиза NaOH, H2, и H2SO4, O2 выделяются соответственно на катоде и аноде. Образовавшиеся газообразные продукты
(H2 и O2) выделяются на электродах, а щелочь и кислота, диффундируя в среднюю часть аппарата, образуют исходную соль - сульфат натрия. Таким образом, в однокамерном аппарате очистка воды от электролита не происходит, а вся электрическая энергия тратится на электролиз воды.
57

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Введение в аппарат мембраны (М), разделяющей его на две части (рис. 3.18 б) и пропускающей ионы электролита, позволяет разделить исходную соль – Na2SO4 на щелочь и кислоту. Однако очистки воды от электролита при этом также не происходит.
Na2SO4
Рис.3.18 Схема, поясняющая различие между электролизом и электродиализом: а – однокамерный; б – двухкамерный; в – трехкамерный аппарат.
Вода может быть очищена от электролита в трехкамерном аппарате
(рис.3.18 в), разделенном двумя мембранами. В этом случае удаление из средней камеры ионов Na+ и SO42- приведет к обессоливанию воды в средней камере, а в боковых камерах будут накапливаться продукты электролиза
NaOH и H2SO4.
Необходимо учесть, что ионы ОН- и H+ , соответственно из катодной и анодной камер, могут переноситься под действием приложенной разности потенциалов в сторону анодной и катодной камер. Такой процесс требует дополнительной затраты энергии и его следует по возможности избегать. Это можно сделать, поставив на катодную и анодную стороны мембраны,
пропускающие соответственно только катионы или анионы. В этом случае вся электрическая энергия (за исключением тепловых потерь) будет расходоваться на полезный процесс удаления электролита (Na2SO4) из
58
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
средней камеры. В связи с этим вопрос о правильном выборе мембран имеет
важное практическое значение.
По электрохимическим свойствам мембраны делятся на три группы:
электрохимически неактивные, электрохимически активные и
идеально электрохимически активные. Электрохимически неактивные мембраны не изменяют числа переноса ионов, т.е. числа переноса ионов в них не отличаются от чисел переноса этих ионов в свободном растворе, с
которым мембрана находится в равновесии. Электрохимически активные мембраны изменяют числа переноса ионов. Наконец, идеально электрохимически активные мембраны пропускают ионы только одного знака.
Напомним, что числом переноса i-иона (ni) называется доля электричества, перенесенная ионами данного вида, от общего количества прошедшего электричества. Сумма чисел переноса всех ионов, находящихся в системе, равна единице, т.е.
ni |
1. |
(3.25) |
i |
|
|
Для случая, когда вода содержит один электролит, сумма чисел переноса катионов (nк0 ) и анионов (nа0 ) равна единице
nk0 na0 |
1, |
(3.26) |
где" 0 " - число переноса ионов в свободном растворе.
Обозначим числа переноса катионов и анионов в мембране через nк и na. Тогда для электрохимически неактивных мембран nк = nк0 и na = nа0. Для электрохимически активных мембран nк ≠ nк0 и na ≠ nа0, а для идеально электрохимически активных мембран nк = 0 и na = 1(мембраны пропускают только анионы) или nк = 1, na = 0 (мембраны пропускают только катионы).
Применение электрохимически активных мембран может значительно интенсифицировать процесс очистки средней камеры электродиализатора от электролита. Для этого на катодную сторону аппарата ставится мембрана,
59

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
увеличивающая числа переноса катионов, а на анодную - увеличивающая числа переноса анионов, т.е. для катодной мембраны nк > nк0 и na < nа0, а для анодной nк < nк0 и na > nа0. В этом случае катодная мембрана будет пропускать преимущественно катионы (ионы Na+) и задерживать прохождение ионов ОН-, образующихся в катодной камере. Для анодной мембраны будет справедливо обратное - она будет пропускать преимущественно анионы удаляемого электролита (ионы SO42-) и
препятствовать прохождению ионов Н+, образующихся в анодной камере электродиализатора. В результате этого большая часть проходящего электричества будет связана с удалением ионов Na+ и SO42- из средней камеры.
В идеальном случае катодная мембрана должна пропускать только катионы, а анодная - анионы. При этом для катодной мембраны nк = 1 и na = 0,а для анодной - nк = 0 и na = 1. Вышесказанное подтверждается рис.3.19, из которого следует, что переход от электрохимически неактивных (кривая 1) к
электрохимически активным (кривая 2) и идеально электрохимически активным (кривая 3) мембранам существенно увеличивает эффективность процесса очистки воды от электролита, а одна и та же степень очистки может быть достигнута при меньших затратах электричества (q1>q2>q3).
Рис. 3.19 Зависимость концентрации электролита в средней камере трехкамерного электродиализатора от количества прошедшего электричества (q=I·t) при применении двух электрохимически неактивных (1), электрохимически активных (2) и идеально электрохимически активных (3) мембран.
60
