

![]()
Графік рівняння Хіла в звичайних (вгорі) та напівлогаріфмічних (внизу) координатах. По вертикалі відкладена частка сайтів зв'язування, окупованих лігандом; по горизонталі - концентрація ліганду. В обох випадках КА=20, n=2.3; видно, що величина КАвідповідає концентрації ліганда, що викликає напівмаксимальний ефект.
В хімії (а особливо в біохімії) досить часто трапляється ситуація, коли зв'язування ліганду з макромолекулоюпосилюється або послаблюється, якщо інша молекула того самого або іншого ліганду вже зв'язана з даної макромолекулою. Рівняння Хіла дозволяє кількісно описати такий ефект. Це рівняння названо на честь англійського фізіолога та біохіміка Арчібальда Вівіана Хіла.
Рівняння описує частку макромолекул, насичених лігандом, як функцію від концентрації ліганду; воно в основному використовується для опису ступеню кооперативності зв'язування ліганду з ферментом або рецептором. Рівняння було вперше використане Арчібальдом Хілом для опису сігмоїдної кривої зв'язування кисню з гемоглобіном[1].
Рівняння Хіла:
![]() ,
де
,
де
![]() -
частка місць (сайтів) зв'язування де
ліганд може зв'язатись з макромолекулою,
які вже окуповані лігандом;
-
частка місць (сайтів) зв'язування де
ліганд може зв'язатись з макромолекулою,
які вже окуповані лігандом;
![]() -
концентрація вільного (не зв'язаного з
макромолекулами, або іншим реакційним
субстратом) ліганду;
-
концентрація вільного (не зв'язаного з
макромолекулами, або іншим реакційним
субстратом) ліганду;
![]() -
уявна константа
дисоціації,
що виводиться з закону
діючих мас;
-
уявна константа
дисоціації,
що виводиться з закону
діючих мас;
![]() -
концентрація ліганду, що призводить до
окупації половини наявних сайтів
зв'язування (або викликає 50%-й
ефект),
яка числено дорівнює мікроскопічній константі
дисоціації;
-
концентрація ліганду, що призводить до
окупації половини наявних сайтів
зв'язування (або викликає 50%-й
ефект),
яка числено дорівнює мікроскопічній константі
дисоціації;
![]() -
коефіцієнт Хіла, що визначає кооперативність
реакції (але інколи і інші біохімічні
властивості, залежно від контексту, в
якому рівняння використовується).
-
коефіцієнт Хіла, що визначає кооперативність
реакції (але інколи і інші біохімічні
властивості, залежно від контексту, в
якому рівняння використовується).
Для
згаданого вище випадку взаємодії кисню
з гемоглобіном ![]() =
2.8 - 3.
=
2.8 - 3.
Інша вживана форма запису рівняння Хіла є наступною:
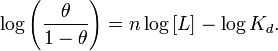
У випадку ліганд-рецепторної взаємодії числове значення коефіцієнту Хіла визначає кооперативність ліганд-рецепторної взаємодії наступним чином:
-
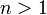 - Позитивна
кооперативність: при
зв'язуванні однієї молекули
ліганда афінність рецептора
до наступної молекули підвищується
(тобто, наступна молекула зв'язується
з більшою вірогідністю);
- Позитивна
кооперативність: при
зв'язуванні однієї молекули
ліганда афінність рецептора
до наступної молекули підвищується
(тобто, наступна молекула зв'язується
з більшою вірогідністю);
-
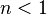 - Негативна
кооперативність: при
зв'язуванні однієї молекули ліганда
афінність рецептора до наступної
молекули знижується;
- Негативна
кооперативність: при
зв'язуванні однієї молекули ліганда
афінність рецептора до наступної
молекули знижується;
-
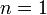 - Некооперативна
реакція: афінність
рецептора або субстрата до ліганда
лишається незмінною незалежно від
кількості молекул ліганда, вже зв'язаних
з рецептором.
- Некооперативна
реакція: афінність
рецептора або субстрата до ліганда
лишається незмінною незалежно від
кількості молекул ліганда, вже зв'язаних
з рецептором.
Рівняння Хіла в контексті кількісного опису взаємозв'язку між концентрацією реакційного субстрату (або кількістю наявних сайтів зв'язування) та часткою окупованих сайтів зв'язування є еквівалентом рівняння Ленгмюра.
Рівняння Хіла з математичної точки зору є логістичною функцією, а в деяких випадках - її логаріфмічної формою; таким чином, при побудові графіку рівняння Хіла на логаріфмічній шкалі цей графік виглядає ідентично логістичному. Це особливо важливо при нелінійній апроксимації експериментальних даних у випадках, коли ефект ліганду є сталим для його концентрацій, які відрізняються на декілька порядків. В цьому випадку для формальної апроксимації експериментальних даних можна (а іноді навіть варто) використовувати логістичну функцію.
[ред.]Посилання
