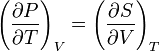Термодинамі́чні потенціа́ли — це набір функцій стану термодинамічної системи, який характеризує її поведінку при термодинамічних процесах. У випадку внутрішньої енергії і вільної енергії, їхня зміна у самочинних процесах дорівнює виконаній системою роботі.
До термодинамічних потенціалів належить внутрішня енергія, ентальпія, вільна енергія (потенціал Гельмгольца), вільна ентальпія (потенціал Гібса) та інші.
З чотирьох основних фізичних величин, які характеризують термодинамічну систему: тиску, об'єму, температури й ентропії, термодинамічні потенціали залежать тільки від двох. Дві інші визначаються, як похідні від термодинамічних потенціалів. Наприклад, знаючи вільну енергію, яка є функцією об'єму й температури, можна знайти тиск, встановивши, таким чином, рівняння стану.
В статистичній фізиці термодинамічні потенціали розраховуються або моделюються. Експериментальні залежності термодинамічних потенціалів від своїх параметрів для конкретних речовин можна знайти в довідниках, що використовуються в теплофізиці.
|
Зміст [сховати]
|
[ред.]Внутрішня енергія
Внутрішня
енергія, як термодинамічний потенціал
є функцією об'єму й ентропії: ![]() .
Для диференціала внутрішньої енергії
справедливе основне співвідношення
.
Для диференціала внутрішньої енергії
справедливе основне співвідношення
![]() ,
,
Таким чином, знаючи залежність вільної енергії від об'єму й ентропії можна визначити тиск і температуру тіла.
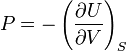
В цій формулі й надалі індекс вказує, що часкова похідна визначається при умові сталості позначеної індексом змінної (в даному випадку — ентропії).
Аналогічно
 [1]
[1]
Детальніші відомості з цієї теми Ви можете знайти в статті Внутрішня енергія.
[ред.]Вільна енергія
Вільна енергія, яку також називають вільною енергією Гельмгольца, визначається, як
![]() .
.
Вільна
енергія зазвичай використовується для
опису ізотермічних процесів і є функцією
об'єму й температури тіла: ![]() .
.
![]() .
.
Таким чином,
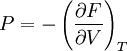 ,
,
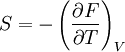
Детальніші відомості з цієї теми Ви можете знайти в статті Вільна енергія.
[ред.]Ентальпія
Ентальпія або теплова функція визначається, як
![]() .
.
Ентальпія
використовується для опису ізобарних
процесів,
тобто процесів, які відбуваються при
сталому тиску. Ентальпія залежить від
тиску й від ентропії системи: ![]()
![]() .
.
Якщо процес проходить при сталому тиску, то приріст ентальпії дорівнює переданій тілу теплоті dQ = TdS.
Таким чином,
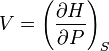 ,
,
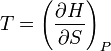 .
.
Детальніші відомості з цієї теми Ви можете знайти в статті Ентальпія.
[ред.]Вільна енергія Гібса
Вільна енергія Гібса, яку ще називають просто термодинамічним потенціалом (у вузькому значенні слова), визначається, як
![]() .
.
Вільна
енергія Гібса є функцією тиску й
температури ![]()
![]() .
.
 ,
,
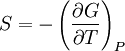 .
.
У випадку системи із змінним числом частинок вільна енергія Гібса залежить окрім тиску й температури від числа частинок
![]() ,
,
де ![]() - хімічний
потенціал і-го
типу частинок.
- хімічний
потенціал і-го
типу частинок.
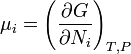 .
.
[ред.]Рівність змішаних похідних
Вважаючи термодинамічні потенціали неперервними функціями своїх змінних та використовуючи рівність змішаних похідних функцій багатьох змінних, можна встановити важливі співвідношенням між похідними термодинамічних змінних. Так, використовуючи вільну енергію: