
- •Методы количественного анализа
- •Весовой метод
- •Объемный анализ (титриметрия)
- •Классификация методов объемного анализа
- •Посуда, применяемая в объемном анализе
- •Способы приготовления титрованных растворов
- •1.Растворы с концентрацией, рассчитанной по точной навеске.
- •2. Растворы с установленной концентрацией
- •3. Использование фиксаналов Методы проведения титриметрического анализа
- •Расчеты в объемном анализе. Применение закона эквивалентов
- •Например: в реакции:
- •Метод нейтрализации
- •Определение эквивалентной точки
- •Метод перманганатометрии
- •Метод йодометрии
- •Комплексонометрический метод
Объемный анализ (титриметрия)
В основе объемного метода лежит титрование – к раствору одного вещества приливают раствор другого вещества, пока они не прореагируют нацело. Точно измеряя объемы смешиваемых растворов и зная концентрацию одного из них, можно на основании закона эквивалентов рассчитать концентрацию другого из них. Один из растворов содержит вещество неизвестной концентрации и представляет собой анализируемый раствор. Второй раствор, который содержит реагент, концентрация которого известна с большой точностью, называется рабочим раствором или титрантом. Момент в процессе титрования, когда количества реагирующих веществ в смеси становятся эквивалентными (прореагируют нацело) называется моментом эквивалентности или эквивалентной точкой.
Достоинством этого метода является быстрота определения при достаточной его точности. Недостаток метода - трудность определения конца титрования и некоторые другие требования к реакциям, лежащим в основе объемных определений, меньшая точность (измерение объемов производится с меньшей точностью, чем взвешивание на аналитических весах).
К химическим реакциям, используемым в объемных методах количественного анализа, предъявляются следующие основные требования:
а) Наличие способа фиксирования точки эквивалентности.
б) Достаточно большая скорость реакции. Вещество, содержащееся в одной капле добавленного раствора, должно вступить в реакцию за время, необходимое для перемешивания этой капли с остальным раствором. Если реакция протекает медленно, то невозможно определить момент эквивалентности.
в) Практическая необратимость (большая величина константы равновесия).
г) Отсутствие побочных реакций.
Классификация методов объемного анализа
В соответствии с тем, какая химическая реакция положена в основу, различаются следующие основные методы объемного анализа:
Метод нейтрализации (кислотно-основное титрование)
В основе этого метода лежит реакция нейтрализации- взаимодействие кислоты с основанием.
Используя метод нейтрализации, можно определять количество кислот, оснований и других веществ, реагирующих с кислотами и основаниями. Используя ионообменники, можно также определять вещества, не реагирующие с кислотами и основаниями(например NaCl, Na2SO4.и др.).
Методы окисления – восстановления (оксидиметрия)
Известно много методов, основанных на реакциях окисления-восстановления, применяемых в объемном анализе. Наиболее широко используются:
а) Перманганатометрия
В основе этого метода лежат реакции окисления перманганатом калия в кислой среде:
MnO4- + 5e + 8H+ = Mn2+ + 4H2O
б) Йодометрия
В этом методе используются окислительные свойства свободного йода и восстановительные свойства йодид-ионов:
I2 + 2e = 2I-
Комплексонометрия
Комплексонометрический метод основан на реакции образования прочных, хорошо растворимых в воде внутрикомплексных соединений ионов металлов с аминополикарбоновыми кислотами и их солями, получившими общее название комплексонов. Наибольшее аналитическое применение нашел комплексон III (трилон Б) – кислая динатриевая соль этилендиаминтетрауксусной кислоты –
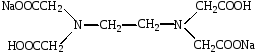
Раствор комплексона III является рабочим раствором метода.
