
- •Виды ингибирования
- •1. Обратимое 2. Необратимое
- •Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
- •1. Специфические и неспецифические ингибиторы
- •1. Пространственная локализация ферментов
- •2. Структура метаболических путей
- •1. Регуляция количества молекул фермента в клетке
- •2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
- •3. Регуляция каталитической активности ферментов
- •Основные способы регуляции активности ферментов:
- •Аллостерическая регуляция
- •Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
- •Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •Энзимодиагностика
- •Энзимотерапия -
1. Специфические и неспецифические ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения
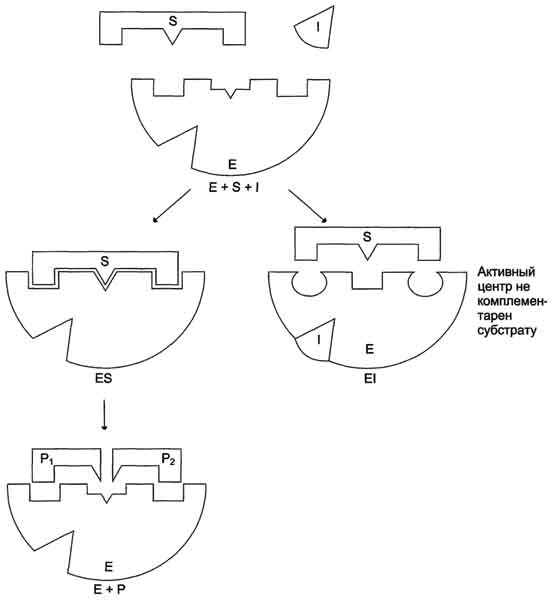
Бесконкурентное ингибирование. При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор меняет конформацию фермента таким образом, что катализ становится невозможным. Для него характерно то, что V и Км изменяются в одинаковой степени.
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Аллостерическое ингибирование: ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К
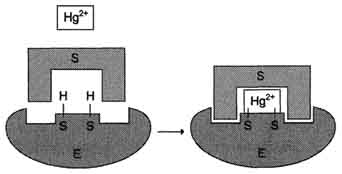
необратимым ингибиторам относят ионы
тяжёлых металлов, например ртути (Hg2+),
серебра (Ag+)
и мышьяка (As3+),
которые в малых концентрациях блокируют
сульфгидрильные группы активного
центра. Субстрат при этом не может
подвергаться химическому превращению.
При наличии
реактиваторов ферментативная функция
восстанавливается.
В больших концентрациях ионы тяжёлых
металлов вызывают денатурацию белковой
молекулы фермента, т.е. приводят к полной
инактивации фермента.
Специфические и неспецифические ингибиторы
Использование
необратимых ингибиторов представляет
большой интерес для выяснения механизма
действия ферментов. С этой целью применяют
вещества,
блокирующие определённые группы
активного центра ферментов. Такие
ингибиторы называют специфическими.
Ряд соединений легко вступает в реакции
с определенными химическими группами.
Если эти группы участвуют в катализе,
то происходит полная инактивация
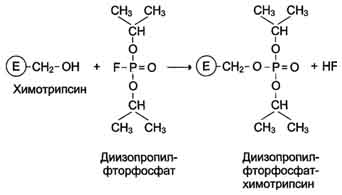
фермента. Диизопропилфторфосфат
(ДФФ)
относят к специфическим необратимым
ингибиторам "сериновых" ферментов,
так как он образует ковалентную связь
с гидроксильной группой серина,
находящегося в активном центре и
играющего ключевую роль в процессе
катализа.
Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков. Эти ингибиторы не относят к специфичным, так как они реагируют с любыми свободными SH-группами белков и называются неспецифическими ингибиторами. Если SH-группы принимают участие непосредственно в катализе, то с помощью этих ингибиторов представляется возможным выявление роли SH-групп фермента в катализе.
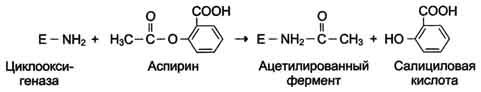
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным) протеолизом.
Организация химических реакций в метаболические пути
Живая клетка - открытая система, при этом она стремится сохранить неизменным свой внутренний состав - клеточный гомеостаз. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм - распад сложных веществ до простых с высвобождением энергии. Анаболизм - синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания, что обеспечивается сложными и многообразными механизмами регуляции.
Оптимальная активность ферментов, катализирующих реакции одного метаболического пути, достигается благодаря определённой пространственной организации в клетке.
